
����Ŀ��I.ij�о���ѧϰС��Ϊ����ȡ���ռ����������������̽�����������ʣ������������ͼ��ʾ��ʵ��װ�ã�
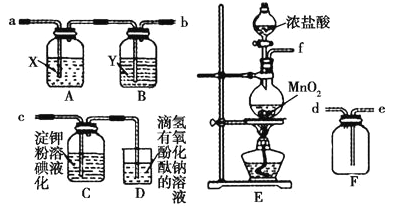
��ش��������⣺
��1������ʵ��װ�õ�����˳����f��_____��_____��____(����ӿڴ�����ĸ����)��
��2��Eװ������ȡ���������ӷ���ʽ��___________________��
��3��Aװ�����Լ�X��___________________��
��4��Cװ���е�������________�������������ԭ����____________(�����ӷ���ʽ�ͱ�Ҫ�����ֽ���)��
II.�����Ͻ����κ��Է���������ԭ��Ӧ��������Ƴ�ԭ��ء������÷�Ӧ��Cu+2Ag+��2Ag+Cu2+������һ����ѧ���(����������̼��)���ش��������⣺
��1���õ��ѡ��ĵ������Һ��______________(�ѧʽ)��
��2�������缫��Ӧ�����ӷ���ʽ��____________________��
��3����������ת�Ƶ���1mol����������������Ϊ_________��
���𰸡� a��b��e��d��c MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O ����ʳ��ˮ ��Һ����ɫ 2I-+Cl2=I2+2C1- ����������� AgNO3 Ag++e-=Ag 108g
Mn2++Cl2��+2H2O ����ʳ��ˮ ��Һ����ɫ 2I-+Cl2=I2+2C1- ����������� AgNO3 Ag++e-=Ag 108g
��������I.��1�����ɵ������к����Ȼ����ˮ�������ռ�֮ǰ��Ҫ���������ñ���ʳ��ˮ��ȥ�Ȼ��⣬Ũ������������������ܶȴ��ڿ��������������ſ������ռ�������������Ҫβ��������������ʵ��װ�õ�����˳����f��a��b��e��d��c����2��Eװ������ȡ���������ӷ���ʽ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O����3���������Ϸ�����֪Aװ�����Լ�X�DZ���ʳ��ˮ����4�������ܰѵ⻯���������ɵ��ʵ⣬������������ɫ����Cװ���е���������Һ����ɫ����Ӧ�����ӷ���ʽΪ2I-+Cl2=I2+2C1-��
Mn2++Cl2��+2H2O����3���������Ϸ�����֪Aװ�����Լ�X�DZ���ʳ��ˮ����4�������ܰѵ⻯���������ɵ��ʵ⣬������������ɫ����Cװ���е���������Һ����ɫ����Ӧ�����ӷ���ʽΪ2I-+Cl2=I2+2C1-��
II.��1�����ڷ�Ӧ�������ӵõ����ӣ���õ��ѡ��ĵ������Һ�ǿ��������Σ�����AgNO3����2�����������ӵõ����ӣ��缫��Ӧ�����ӷ���ʽ��Ag++e-=Ag����3����������ת�Ƶ���1mol������ݵ缫��Ӧʽ��֪������������Ϊ1mol��108g/mol��108g��


 �żӾ���ϵ�д�
�żӾ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��IUPAC����117��Ԫ��ΪTs���������� ![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ���ǣ�������
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ���ǣ�������
A.Ts�ǵ������ڵڢ�A��Ԫ��
B.Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C.Ts��ͬ��Ԫ���зǽ���������
D.������Ϊ176��TS���ط����� ![]() Ts
Ts
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ڻ�����������У���ȷ����
A. ��ϸ���к������Ļ�����һ���ǵ�����
B. ������Ҫ�Ի���������ʽ����
C. ֬���о������ô������õ��ǵ��̴�
D. ����Ҷ��ϸ���������ֺ��ᣬ������4�ֺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ڢ�A��Ԫ�ص�ԭ������Ϊ x����ͬ���ڵĵڢ�A��Ԫ�ص�ԭ�������ǣ� ��
A.ֻ�� x+1
B.������ x+8�� x+18
C.������ x+2
D.������ x+1�� x+11��x+25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��ԭ�Ӻ�Խ���ĵ��������е�����Խ��
B.һ��ԭ�Ӷ������Ӻ�����
C.ϡ������Ԫ�ص�ԭ���������������� 8 ��
D.ԭ�Ӻ����n�������ŵĵ������ض�Ϊ2n2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���ҵ�Ϻϳ����أ�H2NCONH2���ķ�Ӧ���£�2NH3��I��+CO2��g��H2O��I��+H2NCONH2��I����H=��103.7kJmol��1�Իش��������⣺
��1��д��һ��������������صIJ��ʵĴ�ʩ�� ��
��2���ϳ����صķ�Ӧ�ڽ���ʱ��Ϊ���������� ��һ����2NH3��I��+CO2��g��H2NCOONH4��I������������泥���H1
�ڶ�����H2NCOONH4��I��H2O��I��+H2NCONH2��I����H2
ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.2L���ܱ�������Ͷ��4mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯��ͼ����ʾ��
�١�����������Ϊ���ѧʽ��
����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ�����Ӧ��������Ӧ���е�10minʱ����ƽ�⣮��Ӧ���е�10minʱ��á�������������ʵ�����ͼ��ʾ��������ʱ�ʾ�ı�ʾ��ѧ��Ӧ������ΪmolL��1min��L��1
�۵ڶ�����Ӧ��ƽ�ⳣ��K2���¶ȵı仯����ͼ��ʾ�����H1 0 ���������������=������
�ܵ�һ����Ӧ������ϸߡ��ϵ͡����¶��������÷�Ӧ�Է����У�
��3����֪�� N2��g��+O2��g��=2NO��g����H=+180.6kJmol��1
N2��g��+3H2��g��=2NH3��g����H=��92.4kJmol��1
2H2��g��+O2��g��=2H2O��g����H=��483.6kJmol��1
��4NO��g��+4NH3��g��+O2��g���T4N2��g��+6H2O��g����H= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ�����ȷ���ǣ� ��
A.�ƾ��������ᡢ�����Ϊ�����B.���ᡢϡ�������Ȼ�����Һ��Ϊ����
C.��ơ�ʳ��ˮ����ˮ��Ϊ�����D.SO2��SiO2��CO��Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��µ��ܱ������з�����Ӧ2SO2 + O2 ![]() 2SO3������˵����ȷ����
2SO3������˵����ȷ����
A. 2 molSO2��1 molO2��Ӧ������2 molSO3
B. ��������Ӧ���ټ���18O2����ƽ��ʱ��18Oֻ������SO3��
C. �����¶ȣ�ֻ�ܼӿ�2SO2+O2![]() 2SO3(g)��Ӧ������Ӧ����
2SO3(g)��Ӧ������Ӧ����
D. ѡ�����˵Ĵ���������Ӧ���ʣ��������Ч��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com