
| A. | Na与氧气反应只生成Na2O2 | |
| B. | 将SO2通入过量CaCl2溶液可生成CaSO3沉淀 | |
| C. | 向Fe(NO3)2溶液滴加稀盐酸,溶液变黄色 | |
| D. | 向酚酞试液加足量Na2O2粉末,充分振荡后溶液呈红色 |
分析 A.钠和氧气常温反应生成氧化钠,点燃或加热反应生成过氧化钠;
B.盐酸酸性大于亚硫酸,二者不能反应;
C.硝酸亚铁溶液中滴入盐酸,酸溶液中硝酸根离子具有氧化性,能氧化亚铁离子为铁离子;
D.过氧化钠具强氧化性,有漂白作用,能将变红的酚酞褪色.
解答 解:A.钠和氧气常温反应生成氧化钠,4Na+O2=2Na2O,点燃或加热反应生成过氧化钠,2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,条件不同产物不同,故A错误;
B.将SO2通入过量CaCl2溶液,不能发生反应,无沉淀生成,故B错误;
C.向Fe(NO3)2溶液滴加稀盐酸,酸溶液中硝酸根离子具有氧化性,能氧化亚铁离子为铁离子,溶液变黄色,故C正确;
D.Na2O2有强氧化性,将变红的酚酞氧化变为无色,所以溶液先变红后褪色,有气体生成,故D错误;
故选C.
点评 本题考查了金属及其化合物性质的理解应用,注意反应条件不同产物不同,过氧化钠具有氧化性、漂白性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中存在:c(OH-)=c(H+)+c(H2CO3) | |
| B. | 某二元弱酸强碱盐NaHA溶液中存在:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) | |
| C. | CH3COONa和NaCl混合溶液中存在:c(Na+)=c(CH3COO-)+c(Cl-) | |
| D. | 常温下,10mL 0.02mol•L-1 HCl溶液与10mL 0.01mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ•mol-1 | B. | 946 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 1130 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量②>③>①>④ | B. | 体积②>③>①>④ | ||
| C. | 质量②>③>①>④ | D. | 氢原子个数②>③>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | 1.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
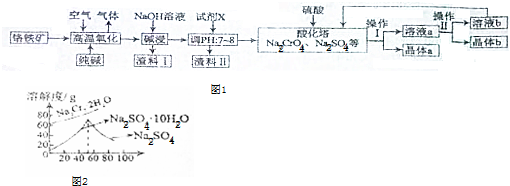
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com