
【题目】下列物质中,含有氯离子的是
A.氯化氢B.氯酸钾C.盐酸D.氯气
科目:高中化学 来源: 题型:
【题目】工业上可利用CO2和H2生成甲醇,热化学方程式如下: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=Q1kJmol﹣1
又查资料得知:①CH3OH(l)+ ![]() O2(g)CO2(g)+H2(g)△H=Q2kJmol﹣1
O2(g)CO2(g)+H2(g)△H=Q2kJmol﹣1
②H2O(g)=H2O(I)△H=Q3kJmol﹣1
则表示甲醇的燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( ) 
A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
B.b点时:c(Na+)=c(CH3COO﹣)
C.c点时:c(OH﹣)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀有气体的化学性质非常稳定,很难发生化学反应,所以曾被称为“惰性气体”,但这种化学惰性是相对的,例如:在一定体积的容器中,加入1.5molXe气和7.5molF2气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5molF2气。则所得无色晶体产物中,氙与氟的原子个数比是
A.1:2
B.1:3
C.1:4
D.1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞中含量在万分之一以上的元素,称为大量元素;含量在万分之一以下的元素,称为微量元素。下列各组元素中,全部是大量元素的是( )
A.O S Mg C HB.Mo H O S Ca
C.Cu N P K FeD.P N K Ca B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为_____________;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=___________;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时________(填增大、减小或无变化,下同);混合气体密度比起始时____________。
(4)下列措施能加快反应速率的是_______________。
A.恒压时充入He B.恒容时充入He C.恒容时充入X
D.及时分离出Z E.升高温度 F.选择高效的催化剂
(5)下列说法正确的是___________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究: 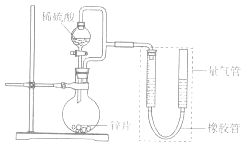
(1)用上述装置探究影响化学反应速率的因素.以生成9.0mL气体为计时终点,结果为t1>t2 .
序号 | V(H2SO4)/mL | C(H2SO4)/molL﹣1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是 .
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号).
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀 ①圆底烧瓶中的试剂可选用(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com