
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是(NA 表示阿伏加德罗常数的值)( )
A.常温常压下,16g CH4含有的氢原子数为4NA
B.1mol羟基(-OH)含有10NA个电子
C.1mol·L-1 NaOH溶液中含有的钠离子为NA
D.标准状况下,33. 6 L CH3CH2OH 中含有的分子数目为1. 5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
以下四组装置在下列实验可供选择

Ⅰ.实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质。请回答下列问题:
(1)应选择的装置是___ _____(填写编号)。
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式__
_ __。
(3)实验结束后,观察到溴水褪色。为解释这一现象,某学习小组的同学提出两种猜想:
A. 发生了加成反应; B. 发生了氧化反应。
为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH,测得溶液的pH下降,你认为发生何种反应,请说出你的理由
________________ ________________________________________________________。
Ⅱ.若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式_______________________________________。
(5)NaOH溶液的作用是(答两点即可)_____________________________________
_ _。
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因_______________ _ ___;
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定某种溶液中只含 四种离子,下列说法错误的是( )
四种离子,下列说法错误的是( )
A.若满足: ,则溶质一定是
,则溶质一定是
B.若满足: ,则溶质一定是
,则溶质一定是 和
和
C.溶液中四种离子之间可能满足:
D.若满足: ,则溶液一定呈中性
,则溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)10 min~20 min以v(CO2)表示的反应速率为________ mol·L-1·s-1。
(1)10 min~20 min以v(CO2)表示的反应速率为________ mol·L-1·s-1。
(2) 在10min和40min这两个时间分别改变了一个条件,则10min时改变的条件可能是________(填选项字母)。
A.升高温度 B.降低温度 C.加入催化剂
D.增加N2的浓度 E.减小NO的浓度 F.减小CO2的浓度
(3) 一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
Ⅱ臭氧是一种在生产生活中有着广泛运用的化学物质,可以用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。目前常用的人工制备臭氧的方法有:电晕放电法、电化学法、紫外线法等。其中电化学法因其设备简易,使用维修简单、安全,生成臭氧成分纯净等特点而得到广泛运用。某课外小组运用下图装置以PbO2做阳极,Pt电极为阴极电解饱和K2SO4溶液制备O3 ,并采用碘量法测定臭氧的产率。(已知电解时在阳极可能有生成O2的副反应发生,碘量法测定的过程中不考虑O2和KI反应 )


实验过程如下:
①按上图连接好装置,检查气密性后接通电源开始进行反应。
②电解的过程中以1.5L/min的速率鼓入N2 ,使产生的O3能够完全被KI溶液吸收,反应后有O2生成(不考虑该过程中溶液体积变化)。
③电解20 min后,通过量筒测得右室中产生的气体体积为224 ml(已转化为标准状况)。
④将充分吸收了O3的300ml KI溶液取出30.00 ml,加入2滴0.1mol/L的淀粉溶液作指示剂,用0.01mol/L的Na2S2O3溶液进行滴定。测得消耗Na2S2O3溶液的体积为31.00ml。(已知反应的化学方程式为:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI )
(1)右室产生的气体为 (填化学式),写出左室发生的电极反应方程式 。
(2)写出KI溶液吸收O3的化学方程式 。
(3)该实验过程中鼓入N2的速率不能过快,若鼓入太快测定出臭氧的产率将偏 (填“大”或“小”),根据实验所得数据,该装置产生臭氧的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,其上标有:①温度 ②浓度 ③容积 ④压强 ⑤刻度线 ⑥酸式或碱式这六项中的
A.②④⑥ B.①③⑤ C.①②④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
200 mL 0.3 mol·L-1的K2SO4溶液和100 mL 0.2 mol·L-1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO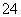 的物质的量浓度为
的物质的量浓度为
A.0.3 mol·L-1 B.0.4 mol·L-1 C.0.45 mol·L-1 D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法是 ( )
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
前四周期原子序数依次增大的元素A,B,C,D中,
A和B 的价电子层中未成对电子均只有1个,平且A-和B+
的价电子层中未成对电子均只有1个,平且A-和B+
 的电子相差为8;与B位于同一周期的C和D,它们价
的电子相差为8;与B位于同一周期的C和D,它们价
电子层中的未成对电子数分别为4和2,且原子序数
相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,
电负性最大的是________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com