
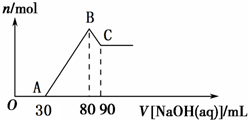
 Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式| 0.08mol |
| 2 |
| 0.04mol |
| 0.04L |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
 如图所示:
如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是
(1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:NH4++2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、误将洁厕灵和“84”消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O |
| C、向明矾溶液中加入少量的Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
| D、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com