
| 10-13 |
| 10-11 |
| c(OH-)V(OH-)-c(H+)V(H+) |
| V(H+)+V(OH-) |
| 10-13 |
| 10-11 |
| c(OH-)V(OH-)-c(H+)V(H+) |
| V(H+)+V(OH-) |
| 0.01mol/L×aL-0.01mol/L×bL |
| a+b |


科目:高中化学 来源: 题型:
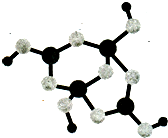 运用物质结构的知识完成B、N元素的问题.
运用物质结构的知识完成B、N元素的问题.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、CuO、HClO、Cu |
| B、普通玻璃、H2O、Fe(SCN)3、葡萄糖 |
| C、KAl(SO4)2?12H2O、KClO3、NH3?H2O、CH3CH2OH |
| D、水玻璃、Na2O?CaO?6SiO2、Ag2O、SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
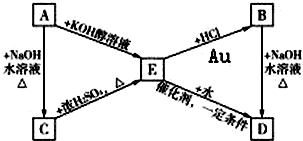 已知R-CH═CH2+HX
已知R-CH═CH2+HX| Au |
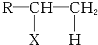 .如图中的A、B分别是分子式为C3H7Cl的两种同分异构体,请根据图中所示物质转化关系和反应条件,判断并写出:
.如图中的A、B分别是分子式为C3H7Cl的两种同分异构体,请根据图中所示物质转化关系和反应条件,判断并写出:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
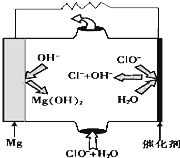 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:| 1 |
| 2 |
| 1 |
| 2 |
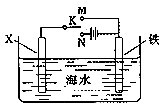
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| W | Z | ||
| T |
| A、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
| B、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| C、由X、Y和氢三种元素形成的化合物中只有共价键 |
| D、物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
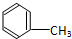 C:CH3CH2OH
C:CH3CH2OH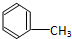 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com