
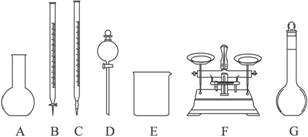
��2�������ƹ����У����в���������ʵ������NaOH��ҺŨ��ƫ�͵��ǣ����ţ�_________��
��ȷȡ����ŨNaOH��Һ�ڿ�����¶��ʱ�������
����������ŨNaOH��Һֱ�Ӽ�������ƿ��������������ˮ��Һ����͵�ǡ�úͻ��ο̶������У�
��ҡ�Ⱥ�Һ����ڿ̶��ߣ��ټ�����ˮ��Һ����͵�ǡ�úͻ��ο̶������У�
��ϡ��NaOH��Һ������δϴ�ӡ�
��������1������0.1 mol��L-1��NaOH��Һ����Ҫ��ʽ�ζ��ܣ�������Ͳ�����ձ�������ƿ����ͷ�ιܡ�������������������Һ���ƣ��ʲ���Ҫ��ƽ��
��2����ŨNaOH��Һ�ڿ�����¶�ù�������Na2CO3���ʣ���NaOH��ҺŨ��ƫ�͡�
��ҡ�Ⱥ�Һ����ڿ̶��ߣ�������Ƭ�̻ᷢ��Һ��ǡ�úͿ̶������У������������ˮ���൱��ϡ��NaOH��Һ�������NaOH��ҺŨ��ƫ�͡�
��ϡ��NaOH��Һ������δϴ�ӣ������NaOH�������ʵ������٣�Ũ��ƫ�͡�
�𰸣���1��ABDF ��ͷ�ιܡ�������
��2���٢ۢ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��12�֣��������A��B��С�⣬�ֱ��Ӧ�ڡ����ʽṹ�����ʡ��͡�ʵ�黯ѧ������ѡ��ģ������ݡ���ѡ������һ�⣬������Ӧ�Ĵ������������������ⶼ������A�����֡�
A�����ںϳɰ��Ĺ�ҵú���к���H2S��C2H5SH�����ᴼ����COS���ʻ���CS2�Ⱥ������ҵ������������п���������л������������������
H2S+ZnO=ZnS+H2O��C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S��COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
��1����ԭ���ڻ�̬ʱ��������Ų�ʽΪ ��
��2�������йط��ӽṹ��˵����ȷ���� ��
A��C2H4��������5��![]() ����1��
����1��![]() ��
��
B��COS���ӣ��ṹ����ͼ���м���C=O>C=S
C��H2S���ӳ�V�νṹ
D��CH4��C2H6������̼ԭ�Ӿ�����sp3�ӻ�
��3�������й�˵������ȷ���� ��
A��H2O��CO��COS���Ǽ��Է���
B����ͬѹǿ�·е㣺Cs2>COS>CO2
C����ͬѹǿ�·е㣺C2H5SH>C2H5OH
D����ͬѹǿ�·е㣺CO>N2
��4��![]() -ZnS�ľ����ṹ����ͼ��������S2-��ĿΪ�� ����
-ZnS�ľ����ṹ����ͼ��������S2-��ĿΪ�� ����
��5���������ƾ����ṹ��ZnS��ZnO��ZnS�۵�Ϊ1830�棬ZnO�۵�Ϊ1975�棬���߽�ǰ�߸������� ��
��6�����һ������ﻯѧʽΪ��Na3[Mo(CN)8]��8H2O������ԭ�ӵ���λ��Ϊ ��
B����ȩ��Ϸ�Ӧ�л��ϳ�����Ϊ��Ҫ����ɫ�����Ĺ��������ᱶ���о��߹�ע��������нϸߵĴ����Լ��ȶ��ԡ���Ӧԭ�����£�
ʵ�鷽������25mL��ƿ�м������ᡢ10mL�״��� 0.5mL����ȩ���ڻ���״̬�·�Ӧ2h����Ӧ�IJ��ʺ�ת���ʾ��dz��ߡ�
��1�����û�����Ӧ2h��Ŀ���� ��
��2���ڷ�Ӧ�м״����������ԭ���� ��
��3����ͬ���������Բ��ʺ�ת����Ӱ�죬���±���
| ��������/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| ����% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| ת����% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
����������ȩ��״����Ϸ�Ӧʵ���д���������������Ϊ ��
��4�������Ļ������������ǿ��������һ�Ϊ��Ҫ��ָ�ꡣ�������ѭ��ʹ�ô����Բ��ʵ�Ӱ��������ͼ����˵������������ŵ�֮һ�� ��
��5��������������ʱ����ͬ��ȩ��״������Ϸ�Ӧ��ת���ʺͲ������±���
| ��� | ȩ | �� | ת����% | ����% |
| 1 | ���ǻ�����ȩ | �״� | 94.3 | 89.6 |
| 2 | ���ǻ�����ȩ | �״� | 93.6 | 88.7 |
| 3 | ���ȱ���ȩ | �״� | 93.1 | 87.3 |
| 4 | ����������ȩ | �״� | 54.2 | 34.1 |
| 5 | ����������ȩ | �״� | 89.9 | 79.5 |
| 6 | ����������ȩ | �״� | 65.7 | 41.9 |
�ӱ��еó��IJ�ͬ��ȩ��״����Ϸ�ӦӰ��ת���ʺͲ��ʵĹ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ�γ��и�����ѧ�������Ի�ѧ���� ���ͣ������
��12�֣��������A��B��С�⣬�ֱ��Ӧ�ڡ����ʽṹ�����ʡ��͡�ʵ�黯ѧ������ѡ��ģ������ݡ���ѡ������һ�⣬������Ӧ�Ĵ������������������ⶼ������A�����֡�
A�����ںϳɰ��Ĺ�ҵú���к���H2S��C2H5SH�����ᴼ����COS���ʻ���CS2�Ⱥ������ҵ������������п���������л������������������
H2S+ZnO=ZnS+H2O��C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S��COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
��1����ԭ���ڻ�̬ʱ��������Ų�ʽΪ ��
��2�������йط��ӽṹ��˵����ȷ���� ��
A��C2H4��������5�� ����1��
����1��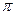 ��
��
B��COS���ӣ��ṹ����ͼ���м���C=O>C=S
C��H2S���ӳ�V�νṹ
D��CH4��C2H6������̼ԭ�Ӿ�����sp3�ӻ�
��3�������й�˵������ȷ���� ��
A��H2O��CO��COS���Ǽ��Է���
B����ͬѹǿ�·е㣺Cs2>COS >CO2
>CO2
C����ͬѹǿ�·е㣺C2H 5SH>C2H5OH
5SH>C2H5OH
D����ͬѹǿ�·е㣺CO>N2
��4�� -ZnS�ľ����ṹ����ͼ��������S2-��ĿΪ�� ����
-ZnS�ľ����ṹ����ͼ��������S2-��ĿΪ�� ����
��5���������ƾ����ṹ��ZnS��ZnO��ZnS�۵�Ϊ1830�棬ZnO�۵�Ϊ1975�棬���߽�ǰ�߸������� ��
��6�����һ������ﻯѧʽΪ��Na3[Mo(CN)8]��8H2O������ԭ�ӵ���λ��Ϊ ��
B����ȩ��Ϸ�Ӧ�л��ϳ�����Ϊ��Ҫ����ɫ�����Ĺ��������ᱶ���о��߹�ע��������нϸߵĴ����Լ��ȶ��ԡ���Ӧԭ�����£�
ʵ�鷽������25mL��ƿ�м������ᡢ10mL�״��� 0.5mL����ȩ���ڻ���״̬�·�Ӧ2h����Ӧ�IJ��ʺ�ת���ʾ��dz��ߡ�
��1�����û�����Ӧ2h��Ŀ���� ��
��2���ڷ�Ӧ�м״����������ԭ���� �� ��3����ͬ���������Բ��ʺ�ת����Ӱ�죬���±���
��3����ͬ���������Բ��ʺ�ת����Ӱ�죬���±���
| ��������/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| ����% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| ת����% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
| ��� | ȩ | �� | ת����% | ����% |
| 1 | ���ǻ�����ȩ | �״� | 94.3 | 89.6 |
| 2 | ���ǻ�����ȩ | �״� | 93.6 | 88.7 |
| 3 | ���ȱ���ȩ | �״� | 93.1 | 87.3 |
| 4 | ����������ȩ | �״� | 54.2 | 34.1 |
| 5 | ����������ȩ | �״� | 89.9 | 79.5 |
| 6 | ����������ȩ | �״� | 65.7 | 41.9 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ���������������һѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������һ����Բ��ϣ�ͨʽΪMO�� xFe2O3��MΪ���۽������ӣ���
����������ɣ�
��1��Ϊ���Ʊ������壬��ȡ5.6g���ۡ�һ������FeCl3(s) ��Ϊԭ�ϣ����Ʊ�Fe3O4���������£���ϡ�����ܽ����ۣ�����FeCl3(s)������һϵ�з�Ӧ�õ�������Fe3O4 [ ��֪1molFe(OH)2��2molFe(OH)3������տɵõ�1mol Fe3O4 ]����Ҫ����FeCl3(s) g��
��2�������MgSO4(s)��FeCl3(s)Ϊԭ���Ʊ�9.0 g MgO�� 2Fe2O3������ȡ������������Ҫ1 mol/L��NaOH(aq)
mL��
��3����һ���Ʊ�Fe3O4��ʵ���У����ڷ�Ӧ��������Ʋ������������һ�ֲ�Ʒ��ȡa�˸ò�Ʒ����100mL���ᣨ�������У���Ҫͨ��672 mL����״����Cl2���ܰ���Һ�е�Fe2+ ȫ������ΪFe3+��Ȼ������������Һ�����������أ���9.6 g���塣���㣺
��ag �ò�Ʒ�����������Һ��Fe2+ �����ʵ���Ũ�ȣ���Һ����仯���Բ��ƣ���
������ò�Ʒ�Ļ�ѧʽ��д��������̣���
��4����һ���ڵ��ӹ�ҵ�㷺Ӧ�õĺ��������壬����ɿɱ�ʾΪ��Fe2+ �� Fe3+[ Fe3+(1-x) �� Cr3+x �� O4]������1.92 mol�����ij��Һ�м���һ�����ĸ��������壬ǡ����ȫ��Ӧ���ռ���NO��NO2�Ļ������2.688 L����״���������㣺������д��������̣�
�ٲμӷ�Ӧ������������ʵ�����
������������NO��NO2������ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010�꽭��ʡ�γ��и�����ѧ�������Ի�ѧ���� ���ͣ������
��12�֣��������A��B��С�⣬�ֱ��Ӧ�ڡ����ʽṹ�����ʡ��͡�ʵ�黯ѧ������ѡ��ģ������ݡ���ѡ������һ�⣬������Ӧ�Ĵ������������������ⶼ������A�����֡�
A�����ںϳɰ��Ĺ�ҵú���к���H2S��C2H5SH�����ᴼ����COS���ʻ���CS2�Ⱥ������ҵ������������п���������л������������������
H2S+ZnO=ZnS+H2O��C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S��COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
��1����ԭ���ڻ�̬ʱ��������Ų�ʽΪ ��
��2�������йط��ӽṹ��˵����ȷ���� ��
A��C2H4��������5�� ����1��
����1�� ��
��
B��COS���ӣ��ṹ����ͼ���м���C=O>C=S
C��H2S���ӳ�V�νṹ
D��CH4��C2H6������̼ԭ�Ӿ�����sp3�ӻ�
��3�������й�˵������ȷ���� ��
A��H2O��CO��COS���Ǽ��Է���
B����ͬѹǿ�·е㣺Cs2>COS>CO2
C����ͬѹǿ�·е㣺C2H5SH>C2H5OH
D����ͬѹǿ�·е㣺CO>N2
��4��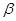 -ZnS�ľ����ṹ����ͼ��������S2-��ĿΪ�� ����
-ZnS�ľ����ṹ����ͼ��������S2-��ĿΪ�� ����

��5���������ƾ����ṹ��ZnS��ZnO��ZnS�۵�Ϊ1830�棬ZnO�۵�Ϊ1975�棬���߽�ǰ�߸������� ��
��6�����һ������ﻯѧʽΪ��Na3[Mo(CN)8]��8H2O������ԭ�ӵ���λ��Ϊ ��
B����ȩ��Ϸ�Ӧ�л��ϳ�����Ϊ��Ҫ����ɫ�����Ĺ��������ᱶ���о��߹�ע��������нϸߵĴ����Լ��ȶ��ԡ���Ӧԭ�����£�

ʵ�鷽������25mL��ƿ�м������ᡢ10mL�״��� 0.5mL����ȩ���ڻ���״̬�·�Ӧ2h����Ӧ�IJ��ʺ�ת���ʾ��dz��ߡ�
��1�����û�����Ӧ2h��Ŀ���� ��
��2���ڷ�Ӧ�м״����������ԭ���� ��
��3����ͬ���������Բ��ʺ�ת����Ӱ�죬���±���
|
��������/mol |
0.01 |
0.02 |
0.03 |
0.05 |
0.1 |
0.15 |
0.2 |
0.6 |
|
����% |
87.3 |
88.2 |
90.3 |
94.2 |
92.9 |
93.1 |
91.8 |
92.3 |
|
ת����% |
89.7 |
92.1 |
93.9 |
98.9[��Դ:Zxxk.Com] |
94.9 |
95.7 |
93.9 |
94.3 |
����������ȩ��״����Ϸ�Ӧʵ���д���������������Ϊ ��
��4�������Ļ������������ǿ��������һ�Ϊ��Ҫ��ָ�ꡣ�������ѭ��ʹ�ô����Բ��ʵ�Ӱ��������ͼ����˵������������ŵ�֮һ�� ��
��5��������������ʱ����ͬ��ȩ��״������Ϸ�Ӧ��ת���ʺͲ������±���
|
��� |
ȩ |
�� |
ת����% |
����% |
|
1 |
���ǻ�����ȩ |
�״� |
94.3 |
89.6 |
|
2 |
���ǻ�����ȩ |
�״� |
93.6 |
88.7 |
|
3 |
���ȱ���ȩ |
�״� |
93.1 |
87.3 |
|
4 |
����������ȩ |
�״� |
54.2 |
34.1 |
|
5 |
����������ȩ |
�״� |
89.9 |
79.5 |
|
6 |
����������ȩ |
�״� |
65.7 |
41.9 |

�ӱ��еó��IJ�ͬ��ȩ��״����Ϸ�ӦӰ��ת���ʺͲ��ʵĹ����� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com