
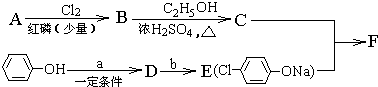
| Cl2 |
| ŗģĮ×(ÉŁĮæ) |
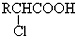 £¬
£¬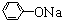 +RCl”ś
+RCl”ś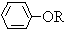 +NaCl
+NaCl| 8.8 |
| 0.1 |
 £¬ŌņAĪŖ
£¬ŌņAĪŖ £¬¹ŹCµÄ½į¹¹¼ņŹ½ĪŖ
£¬¹ŹCµÄ½į¹¹¼ņŹ½ĪŖ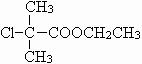 £®Óɱ½·Ó”śD”śE×Ŗ»Æ£¬½įŗĻ±½·Ó”¢EµÄ½į¹¹¼ņŹ½æÉÖŖ£¬DĪŖ
£®Óɱ½·Ó”śD”śE×Ŗ»Æ£¬½įŗĻ±½·Ó”¢EµÄ½į¹¹¼ņŹ½æÉÖŖ£¬DĪŖ £¬ŹŌ¼ĮaĪŖĀČĘų£¬D×Ŗ»ÆbŹ±·ÓōĒ»ł·¢Éś·“Ó¦£¬¹ŹŹŌ¼ĮbæÉŅŌĪŖNa2CO3ČÜŅŗ£¬CÓėF·¢ÉśČ”“ś·“Ӧɜ³ÉFĪŖ
£¬ŹŌ¼ĮaĪŖĀČĘų£¬D×Ŗ»ÆbŹ±·ÓōĒ»ł·¢Éś·“Ó¦£¬¹ŹŹŌ¼ĮbæÉŅŌĪŖNa2CO3ČÜŅŗ£¬CÓėF·¢ÉśČ”“ś·“Ӧɜ³ÉFĪŖ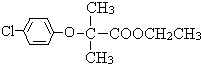 £¬¾Ż“Ė½ā“š
£¬¾Ż“Ė½ā“š| 8.8 |
| 0.1 |
 £¬ŌņAĪŖ
£¬ŌņAĪŖ £¬¹ŹCµÄ½į¹¹¼ņŹ½ĪŖ
£¬¹ŹCµÄ½į¹¹¼ņŹ½ĪŖ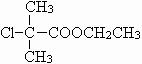 £®Óɱ½·Ó”śD”śE×Ŗ»Æ£¬½įŗĻ±½·Ó”¢EµÄ½į¹¹¼ņŹ½æÉÖŖ£¬DĪŖ
£®Óɱ½·Ó”śD”śE×Ŗ»Æ£¬½įŗĻ±½·Ó”¢EµÄ½į¹¹¼ņŹ½æÉÖŖ£¬DĪŖ £¬ŹŌ¼ĮaĪŖĀČĘų£¬D×Ŗ»ÆbŹ±·ÓōĒ»ł·¢Éś·“Ó¦£¬¹ŹŹŌ¼ĮbæÉŅŌĪŖNa2CO3ČÜŅŗ£¬CÓėF·¢ÉśČ”“ś·“Ӧɜ³ÉFĪŖ
£¬ŹŌ¼ĮaĪŖĀČĘų£¬D×Ŗ»ÆbŹ±·ÓōĒ»ł·¢Éś·“Ó¦£¬¹ŹŹŌ¼ĮbæÉŅŌĪŖNa2CO3ČÜŅŗ£¬CÓėF·¢ÉśČ”“ś·“Ӧɜ³ÉFĪŖ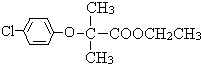 £¬
£¬ £¬
£¬ £»
£» £¬ŗ¬ÓŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ£ŗĀČŌ×Ó”¢·ÓōĒ»ł£» bĖł“ś±ķµÄŹŌ¼Į£ŗNa2CO3ČÜŅŗ£¬
£¬ŗ¬ÓŠ¹ŁÄÜĶŵÄĆū³ĘĪŖ£ŗĀČŌ×Ó”¢·ÓōĒ»ł£» bĖł“ś±ķµÄŹŌ¼Į£ŗNa2CO3ČÜŅŗ£¬ Č”“ś£¬ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬FµÄ½į¹¹¼ņŹ½ĪŖ£ŗ
Č”“ś£¬ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬FµÄ½į¹¹¼ņŹ½ĪŖ£ŗ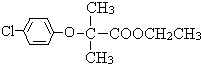 £¬¹Ź“š°øĪŖ£ŗČ”“ś·“Ó¦£»
£¬¹Ź“š°øĪŖ£ŗČ”“ś·“Ó¦£»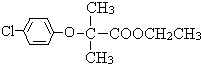 £»
£»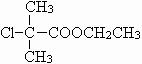 £©·¢ÉśĻūČ„·“Ó¦µÄ²śĪļGĪŖCH2=C£ØCH3£©COOCH2CH3£¬GÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬·ūŗĻĻĀĮŠĖłÓŠĢõ¼žµÄĶ¬·ÖŅģ¹¹Ģå£ŗÓėG¾ßÓŠĻąĶ¬¹ŁÄÜĶÅ£¬ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬Ó¦ŗ¬ÓŠ¼×ĖįŠĪ³ÉµÄõ„»ł£¬ĒŅ½į¹¹ÖŠÖ»ÓŠŅ»øö¼×»ł£¬·ūŗĻĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåÓŠ£ŗHCOOCH2CH2CH=CHCH3”¢HCOOCH2CH=CHCH2CH3”¢HCOOCH=CHCH2CH3”¢HCOOCH2CH2C£ØCH3£©=CH2”¢HCOOCH2CH£ØCH3£©CH=CH2”¢HCOOCH£ØCH3£©CH2CH=CH2”¢HCOOCH2C£ØCH2CH3£©=CH2”¢HCOOCH£ØCH2CH3£©CH=CH2£¬ĖłŅŌŅ»¹²ÓŠ8ÖÖ£¬¹Ź“š°øĪŖ£ŗ8£®
£©·¢ÉśĻūČ„·“Ó¦µÄ²śĪļGĪŖCH2=C£ØCH3£©COOCH2CH3£¬GÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬·ūŗĻĻĀĮŠĖłÓŠĢõ¼žµÄĶ¬·ÖŅģ¹¹Ģå£ŗÓėG¾ßÓŠĻąĶ¬¹ŁÄÜĶÅ£¬ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬Ó¦ŗ¬ÓŠ¼×ĖįŠĪ³ÉµÄõ„»ł£¬ĒŅ½į¹¹ÖŠÖ»ÓŠŅ»øö¼×»ł£¬·ūŗĻĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåÓŠ£ŗHCOOCH2CH2CH=CHCH3”¢HCOOCH2CH=CHCH2CH3”¢HCOOCH=CHCH2CH3”¢HCOOCH2CH2C£ØCH3£©=CH2”¢HCOOCH2CH£ØCH3£©CH=CH2”¢HCOOCH£ØCH3£©CH2CH=CH2”¢HCOOCH2C£ØCH2CH3£©=CH2”¢HCOOCH£ØCH2CH3£©CH=CH2£¬ĖłŅŌŅ»¹²ÓŠ8ÖÖ£¬¹Ź“š°øĪŖ£ŗ8£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| AӢ11.2 g |
| BӢ25.2 g |
| CӢ16.8 g |
| DӢ33.6 g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 ÓĆ0.1320mol/LµÄHClČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄNaOHČÜŅŗ£¬ŹµŃ鏿¾ŻČēĻĀ±ķĖłŹ¾£¬
ÓĆ0.1320mol/LµÄHClČÜŅŗµĪ¶ØĪ“ÖŖÅØ¶ČµÄNaOHČÜŅŗ£¬ŹµŃ鏿¾ŻČēĻĀ±ķĖłŹ¾£¬| ŹµŃ鱹ŗÅ | “ż²āNaOHČÜŅŗµÄĢå»ż/mL | HClČÜŅŗµÄĢå»ż/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 22.60 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
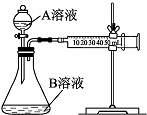 ŹµŃ銔×éĄūÓĆĖįŠŌKMnO4ČÜŅŗÓėH2C2O4ČÜŅŗ·“Ӧъ¾æÓ°Ļģ·“Ó¦ĖŁĀŹµÄŅņĖŲ£®
ŹµŃ銔×éĄūÓĆĖįŠŌKMnO4ČÜŅŗÓėH2C2O4ČÜŅŗ·“Ӧъ¾æÓ°Ļģ·“Ó¦ĖŁĀŹµÄŅņĖŲ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| µĪ¶ØŠņŗÅ | “ż²āŅŗĢå»ż | ĖłĻūŗÄŃĪĖį±ź×¼µÄĢå»ż£ØmL£© | |
| µĪ¶ØĒ° | µĪ¶Øŗó | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ŹµŃé·½°ø £ØÖ»ŅŖĒóĢīŠ“Ń”ÓĆŹŌ¼ĮµÄŠņŗÅ£© | ŹµŃéĻÖĻó | ½įĀŪ | |
| £Ø1£© | Ņ»Ö§ŹŌ¹ÜÖŠÓŠ°×É«³Įµķ£¬ĮķŅ»Ö§ŹŌ¹ÜÖŠĻČÉś³É°×É«³Įµķ£¬ŗó°×É«³ĮµķĻūŹ§£® | ½šŹōŠŌ£ŗMg£¾Al | |
| £Ø2£© | ·Ē½šŹōŠŌ£ŗ | ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| AӢH2CO3 |
| BӢCl2 |
| CӢCaCO3 |
| DӢNH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| A”¢¹żĮæµÄNaHSO4ÓėBa£ØOH£©2ČÜŅŗ·“Ó¦£ŗBa2++2OH-+2H++SO42-=BaSO4”ż+2H2O |
| B”¢ĮņĖįĆ¾ČÜŅŗøśĒāŃõ»Æ±µČÜŅŗ·“Ó¦£ŗSO42-+Ba2+=BaSO4”ż |
| C”¢NH4HCO3ČÜŅŗÓė¹żĮæNaOHČÜŅŗ·“Ó¦£ŗNH4++OH-=NH3”ü+H2O |
| D”¢ĻņĢ¼ĖįĒāÄĘČÜŅŗÖŠµĪ¼ÓÉŁĮæĻ”ĻõĖį£ŗCO32-+2H +=CO2”ü +H2O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com