
【题目】Ⅰ.写出下列反应的离子方程式:
(1)将鸡蛋壳在醋酸中溶解有气泡产生:______________________________________;
(2)CuSO4溶液与Ba(OH)2溶液混合:________________________________________。
(3)铁片插入硝酸银溶液中:_________________________________________________。
Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有![]() 、Na+、
、Na+、![]() 、H+、
、H+、![]() 、
、![]() 、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________,一定不存在的离子是____________。
(2)在上述实验操作中,有错误的步骤是_________(填代号)。对该错误改正的方法是(要作较详细的说明)_________________________________________________________。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是____________。
【答案】 CaCO3+2CH3COOH=Ca2++2CH3COO- + CO2↑+ H2O Cu2+ +![]() + Ba2+ +2OH- = Cu(OH)2↓ + Ba SO4↓ Fe+2 Ag+ =Fe2+ +Ag H+,
+ Ba2+ +2OH- = Cu(OH)2↓ + Ba SO4↓ Fe+2 Ag+ =Fe2+ +Ag H+,![]()
![]() 、H
、H![]() ② 应将BaCl2 改为Ba(NO3)2 ②中加入BaCl2 溶液也会使③中产生Ag Cl 沉淀,不能判断原溶液中是否存在Cl Na+、
② 应将BaCl2 改为Ba(NO3)2 ②中加入BaCl2 溶液也会使③中产生Ag Cl 沉淀,不能判断原溶液中是否存在Cl Na+、![]() 、Cl
、Cl
【解析】Ⅰ.(1)将鸡蛋壳在醋酸中溶解有气泡产生,说明醋酸与鸡蛋壳中主要成分碳酸钙发生复分解反应,离子方程式为:CaCO3+2CH3COOH=Ca2++2CH3COO- + CO2↑+ H2O
(2)CuSO4溶液与Ba(OH)2溶液混合发生复分解反应,其离子方程式为: Cu2+ +SO42—+ Ba2+ +2OH- = Cu(OH)2↓ + Ba SO4↓
(3)铁片插入硝酸银溶液中发生置换反应,其离子方程式为:Fe+2 Ag+ =Fe2+ +Ag。
Ⅱ.用石蕊试液检测该溶液,溶液显红色,说明溶液呈酸性,说明溶液呈酸性,CO32-、HCO3-与H+离子反应,不能大量共存,则一定不含有CO32-、HCO3-;
②加入足量氯化钡和稀硝酸溶液,结果生成了不溶于稀硝酸的白色沉淀,该沉淀为BaSO4,说明溶液中含有SO42-离子;
③取②中的上层清液,此时引入氯离子,加入硝酸银溶液,结果又生成了不溶于稀硝酸的白色沉淀,不能说明溶液中含有Cl-离子;
(1)原溶液中一定存在的离子是H+、SO42-,一定没有CO32-、HCO3-离子;
(2)在上述实验操作②中,应将BaCl2 改为Ba(NO3)2 ,因为原操作②中加入BaCl2 溶液也会使③中产生AgCl沉淀,不能判断原溶液中是否存在Cl ;
(3)到目前为止,不能肯定在原溶液中是否存在的离子是Na+、NO3-、Cl;


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是()
A. 用广范pH试纸测得某溶液的pH为0
B. 可用铁粉鉴别浓硫酸和稀硫酸
C. 蒸馏是分离液态混合物的一种常用方法,广泛应用于石油工业
D. 品红溶液可用于鉴别SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
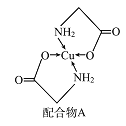


(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②氯水与KI溶液反应(写出离子方程式)_____________________________。
③苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是

A. 图中A、B、D三点处Kw的大小关系:B>A>D
B. 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C. 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D. A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是

A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下11.2 L的甲烷气体含有甲烷分子数为0.5 NA个
B. 14g乙烯和丙烯的混合物中总原子数为3 NA个
C. 0.1 mol/L的氢氧化钠溶液中含钠离子数为0.1 NA个
D. 5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A、金刚石和石墨 B、C2H6和C5H12 C、12C和14C D、正丁烷和异戊烷 E、葡萄糖和果糖 F、红磷和白磷G、NH4CNO与尿素(CO(NH2)2) H、35Cl和37Cl I、 J、
J、
(1)属于同分异构体的是 ____________(填序号,下同);
(2)属于同素异形体的是__________(3)属于同系物的是___________
(4)属于同位素的是______________(5)属于同一种物质的是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:①CO的结构式为C![]() O;②298K时相关化学键的键能数据如下表:
O;②298K时相关化学键的键能数据如下表:
化学键 | H—H | O—H | C—H | C |
E/(KJ·mol-1) | 436 | 465 | 413 | 1076 |
则反应 CO(g)+3H2(g)![]() CH4(g)+H2O(g)的△H的值为
CH4(g)+H2O(g)的△H的值为
A. -198kJ·mol-1 B. +267 kJ·mol-1 C. -298 kJ·mol-1 D. +634 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com