
| A. | 化学实验室不必备有灭火器等防火器材 | |
| B. | 稀释浓硫酸时要把浓硫酸慢慢注入水中且不断搅拌 | |
| C. | 化学实验室空间较小,易燃易爆物跟其他物质可混存 | |
| D. | 一切能产生有毒气体的实验均不能在实验室中进行 |
分析 A.化学实验室也要有防火器材;
B.浓硫酸稀释放出大量的热;
C.易燃易爆物不可跟其他物质混存;
D.产生有毒气体,采取封闭式体系进行.
解答 解:A.化学实验中也有发生火灾的危险,所以化学实验室也要有防火器材,故A错误;
B.稀释浓硫酸时要把浓硫酸慢慢注入水中且不断搅拌,故B正确;
C.任何条件下易燃易爆物都不可跟其他物质混存,故C错误;
D.化学实验中产生有毒气体,可以采取封闭式体系进行,故D错误.
故选B.
点评 本题考查化学实验中产生有毒气体,可以采取封闭式体系进行,防止有毒气体泄漏污染空气,危害师生健康,难度不大,对实验中产生的以及实验后残留的有毒气体进行适当处理,消除危害.


科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:Fe3++3OH-=Fe(OH)3↓ | |
| B. | 稀硝酸中加入过量的铁粉:3Fe+2NO${\;}_{3}^{-}$+8H+=3Fe2++2NO↑+4H2O | |
| C. | 向Na2SiO3溶液中加入通入过量的H2S:SiO32-+H2SiO3↓+S2- | |
| D. | 向含amolFel2的水溶液中通入amol的Cl2反应为:2Fe2-+2l-+2Cl2=2Fe2++4Cl-+l2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在28 g聚乙烯树脂中,含有的碳原子数目为2NA | |
| B. | 在合成28 g聚乙烯树脂的单体中,含有的双键数目为NA | |
| C. | 28 g聚乙烯树脂完全燃烧时,转移的电子数目为3NA | |
| D. | 28 g聚乙烯树脂中,含有的C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
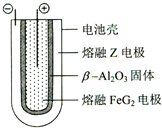 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题: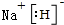 ;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑. Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26.0kJ | B. | 155.8kJ | C. | 51.9kJ | D. | 467.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | Mg条插入NaOH溶液中 | 有气泡产生 | Mg可以和NaOH溶液反应 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰无紫色 | 原溶液中无K+ |
| C | 用玻璃棒蘸取氨水点到红色石蕊试纸上 | 试纸变蓝色 | 氨水呈碱性 |
| D | CO2通入CaCl2水溶液中 | 溶液变浑浊 | 生成CaCO3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com