

分析 硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁[Fe2(OH)n(SO4)3-n/2]m和绿矾(FeSO4•7H2O),烧渣在硫酸溶液中通入足量氧气,反应后过滤得到固体W和溶液X,溶液X加入铁反应生成硫酸亚铁,蒸发浓缩结晶析出得到绿矾,溶液X中加入试剂调节溶液PH得到溶液Z加热制备聚铁胶体得到聚铁;
(1)过程①FeS和O2、H2SO4反应生成硫酸铁,水和硫;
(2)依据二氧化硫具有漂白性设计实验验证二氧化硫气体;
(3)氯化铁溶液中加入过滤铁粉反应生成硫酸亚铁过滤后得到溶液Y,再经浓缩、结晶等步骤得到绿矾;
(4)溶液Z的pH将影响聚铁中铁的质量分数,若溶液Z的pH偏小,利用pH试纸测定溶液酸碱性的方法来分析.
解答 解:(1)过程①FeS和O2、H2SO4反应生成硫酸铁,水和硫,反应的化学方程式为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(2)二氧化硫具有漂白性,验证固体W焙烧后产生的气体含有SO2的方法是:将产生的气体通入品红溶液中,若品红溶液褪色,加热后又变红,证明含有SO2;
故答案为:将产生的气体通入品红溶液中,若品红溶液褪色,加热后又变红,证明含有SO2;
(3)因为在烧渣中加入了硫酸和足量氧气,故溶液Y中含有Fe3+,故应先加入过量的铁粉,然后过滤;
故答案为:铁粉;过滤;
(4)用pH试纸测定方法为:将试纸放在表面皿上,用洁净的玻璃棒蘸取待测液,点在试纸的中央,然后与标准比色卡对比.氢氧化铁的含量比硫酸亚铁高,若溶液Z的PH偏小,则聚铁中生成的氢氧根的含量减少,使铁的含量减少;过程②中将溶液加热到70~80℃的目的是促进Fe3+的水解;
故答案为:低;促进Fe3+的水解.
点评 本题借助于实验考查基础知识达到了很好的效果.对学生来说聚铁不是很熟悉,但是铁与亚铁之间的转化还是很容易实现的,起点高,落点低,是一好题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置检验对应气体时,不能达到目的是( )
用如图所示装置检验对应气体时,不能达到目的是( )| 生成的气体 | 试剂X | 试剂Y | |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | Br2的CCl4溶液 |
| B | 木炭与浓H2SO4加热制取的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH乙醇溶液共热制取的乙烯 | 水 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
| n(CO) | n(H2O) | n(CO2) | n(H2) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
| ② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
| ③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
| A. | 若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L•min) | |
| B. | 容器③中,开始时υ(CO)生成>υ(CO)消耗 | |
| C. | 达平衡过程体系能量的变化:Q1=4Q2 | |
| D. | 平衡时,①与②容器中CO的体积分数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
| A. | 正反应为吸热反应 | |
| B. | 实验1中,CO的转化率为80% | |
| C. | 650℃时,化学平衡常数K=$\frac{8}{3}$ | |
| D. | 实验1再加入1.0 mol H2O,重新达到平衡时,n(CO2)为1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
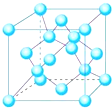 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).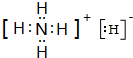 ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| B. | 逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都不变,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都减慢,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com