
| A. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOHCH2CH3+H2O | |
| B. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| C. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | CH3CH2OH+HBr→CH3CH2Br+H2O |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
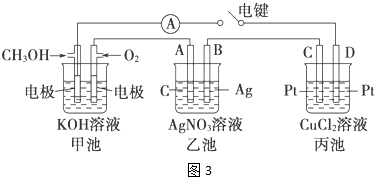
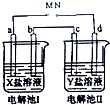 下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.
下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: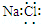 | |
| B. | 聚乙烯的结构简式: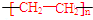 | |
| C. | 硫离子的结构示意图: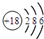 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和体积一定时,容器内压强不再变化 | |
| B. | 生成H2和生成HI的速率相等 | |
| C. | 混合气体的颜色不再变化 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积分数75%的乙醇溶液常用于医疗消毒 | |
| B. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得各种烷烃、苯及其他衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
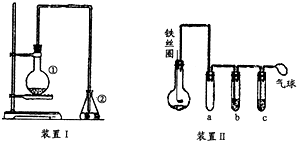 为探究苯与溴的取代反应,甲同学用如图所示的装置Ⅰ进行实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
为探究苯与溴的取代反应,甲同学用如图所示的装置Ⅰ进行实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应. .
. 与Br2,要想得到纯净的产物,可用NaOH溶液试剂.洗涤后分离粗产吕应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液试剂.洗涤后分离粗产吕应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
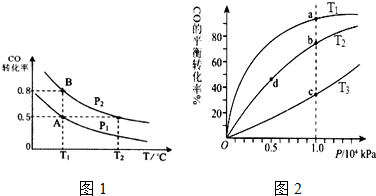
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
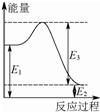 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
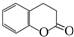 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(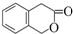 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com