
| A. | 质子数为7、中子数为7的氮原子:${\;}_7^{14}$N | |
| B. | 氮原子的结构示意图: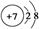 | |
| C. | 氨气分子的电子式: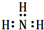 | |
| D. | 对硝基甲苯的结构简式: |
分析 A、质量数A=质子数Z+中子数N;
B、氮原子的最外层有5个电子;
C、氮原子的最外层有5个电子,其中三个与三个氢原子形成3对共用电子对;
D、对硝基甲苯中,硝基和甲基在苯环上处于对位的位置.
解答 解:A、质量数A=质子数Z+中子数N,故质子数为7、中子数为7的氮原子的质量数为14,故表示为${\;}_7^{14}$N,故A正确;
B、氮原子的最外层有5个电子,故结构示意图为: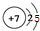 ,故B错误;
,故B错误;
C、氮原子的最外层有5个电子,其中三个与三个氢原子形成3对共用电子对,故氨气的电子式为: ,故C错误;
,故C错误;
D、对硝基甲苯中,硝基和甲基在苯环上处于对位的位置,且与苯环直接相连的是N原子,而非O原子,故结构简式应为 ,故D错误.
,故D错误.
故选A.
点评 本题考查化学用语,难度不大,注意对对硝基甲苯中是N原子直接与苯环相连,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 溶液呈黄绿色,且具有刺激性气味,说明Cl2的存在 | |
| B. | 加入有色布条,有色布条褪色,说明溶液中有Cl2存在 | |
| C. | 加入NaHCO3溶液,有无色气体产生,说明有HClO存在 | |
| D. | 先加入盐酸酸化,再加AgNO3溶液产生白色沉淀,说明有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可作食品的包装材料 | |
| C. | 碳酸氢钠可于治疗胃酸过多症 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素的化合价为+4,是含碳的化合物,因此属于有机物 | |
| B. | 硝酸铵本身既具有氧化性又具有还原性,受热或撞击易发生爆炸 | |
| C. | 爆炸发生引发大火,可以用大量水灭火 | |
| D. | 为防止中毒,可用H2O2将NaCN还原为无毒物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
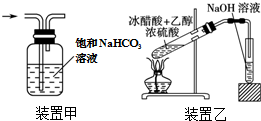
| A. | 将25.0gCuSO4•5H2O溶于100mL蒸馏水,配得1.0mol•L-1硫酸铜溶液 | |
| B. | 焰色反应实验中,在蘸取待测溶液前,先用稀盐酸洗净铂丝并灼烧至火焰为无色 | |
| C. | 用装置甲除去Cl2中的HCl气体 | |
| D. | 用装置乙制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
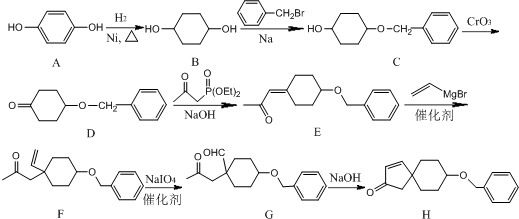
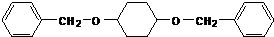 ;由C→D的反应类型是氧化反应.
;由C→D的反应类型是氧化反应.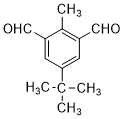 或
或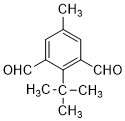 .
. 为有机原料制备
为有机原料制备 的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选,可选择适当有机溶剂).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com