
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
(1)��֪��2SO2(g)��O2(g)  2SO3(g)
2SO3(g)
��H����196.6 kJ/mol
2NO(g)��O 2(g)
2(g)  2NO2(g)����H����113.0 kJ/mol
2NO2(g)����H����113.0 kJ/mol
��ӦNO2(g)��SO2(g)  SO3(g)��NO(g)�Ħ�H��________ kJ/mol��
SO3(g)��NO(g)�Ħ�H��________ kJ/mol��
һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����________��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K��________��
 (2)CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g)
(2)CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g)  CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250�桢1.3��104 kPa���ң�ѡ���ѹǿ��������_____________________��
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H________0(�>����<��)��ʵ����������������250�桢1.3��104 kPa���ң�ѡ���ѹǿ��������_____________________��
������(1)��������������Ӧ����ʽ�ֱ��עΪ
2SO2(g)��O2(g)  2SO3(g)����H1����196.6 kJ/mol��2NO(g)��O2(g)
2SO3(g)����H1����196.6 kJ/mol��2NO(g)��O2(g)  2NO2(g)����H2����113.0 kJ/mol�������ܷ�Ӧ����ʽ�Ħ�HΪ��H3����H3��
2NO2(g)����H2����113.0 kJ/mol�������ܷ�Ӧ����ʽ�Ħ�HΪ��H3����H3�� ��
�� ����41.8 kJ/mol��
����41.8 kJ/mol��
��2�ʣ����ڸ÷�Ӧ Ϊ��Ӧǰ�����������ȵķ�Ӧ������ϵ��ѹǿʼ�ձ��ֲ��䣬�ʲ�����ѹǿ������Ϊ�жϱ�־��a����SO3��NO�������ʼ�ձ���1��1��C�����ݡ��췽�����൱����ԭ����֪d����
Ϊ��Ӧǰ�����������ȵķ�Ӧ������ϵ��ѹǿʼ�ձ��ֲ��䣬�ʲ�����ѹǿ������Ϊ�жϱ�־��a����SO3��NO�������ʼ�ձ���1��1��C�����ݡ��췽�����൱����ԭ����֪d����
��NO2��SO2����ʼ�������ֱ�Ϊ1 mol��2 mol���������ΪV�����У�(��NO2��ת����Ϊx)
NO2(g)��SO2(g)  SO3(g)��NO(g)
SO3(g)��NO(g)
��ʼ��(mol)����1��������2�������� 0��������0
ת����(mol) x x x x
ƽ����(mol) 1��x 2��x x x
�������� ��
�� ����x��0.8 mol��
����x��0.8 mol��
ƽ�ⳣ��K�� ��
�� ��2.67��
��2.67��
(2)��ͼ�������������¶ȵ����ߣ�CO��ת���ʱ�С���ʦ�H<0���ۺ��¶ȡ�ѹǿ��COת���ʵ�Ӱ�������������ѹǿ�£�CO��ת�����Ѿ��ܴ�
�𰸣�(1)��41.8��b��2.67��
(2)<����1.3��104 kPa�£�CO��ת�����ѽϸߣ�������ѹǿCOת������߲���ͬʱ�����ɱ����ӣ� �ò���ʧ
�ò���ʧ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��Ӧ��2CH3COCH3(l)  CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0 ���20 ���£������ת��������ʱ��仯�Ĺ�ϵ����(Y��t)��ͼ��ʾ������˵����ȷ����(����)
CH3COCH2COH(CH3)2(l)��ȡ����CH3COCH3���ֱ���0 ���20 ���£������ת��������ʱ��仯�Ĺ�ϵ����(Y��t)��ͼ��ʾ������˵����ȷ����(����)
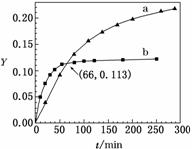
A��b����0 ����CH3COCH3��Y��t����
B����Ӧ���е�20 minĩ��CH3COCH3��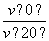 >1
>1
C�������¶ȿ����̷�Ӧ��ƽ���ʱ�䲢�����ƽ��ת����
D����Y��0��Y��0.113��CH3COCH2COH(CH3)2��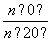 ��1
��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ԭ�ϻ��ƳɵIJ�Ʒ�У������������Խ�����������(����)
A��������ϩ��Ь B����ľ����
C���۱�ϩ���� D������ϩ����Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
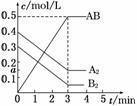 ��һ���ݻ�Ϊ2 L���ܱ������У�����0.8 mol��A2�����0.6 mol B2���壬һ�������·������·�Ӧ��A2(g)��B2(g)
��һ���ݻ�Ϊ2 L���ܱ������У�����0.8 mol��A2�����0.6 mol B2���壬һ�������·������·�Ӧ��A2(g)��B2(g)  2AB(g)����H<0����Ӧ�и����ʵ�Ũ����ʱ��ı仯�����ͼ��ʾ������˵������ȷ����(����)
2AB(g)����H<0����Ӧ�и����ʵ�Ũ����ʱ��ı仯�����ͼ��ʾ������˵������ȷ����(����)
A��ͼ��a���ֵΪ0.15
B���÷�Ӧ��ƽ�ⳣ��K��0.03
C���¶����ߣ�ƽ�ⳣ��Kֵ��С
D��ƽ��ʱA2��ת����Ϊ62.5%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
N2O5��һ����������������һ���¶��¿ɷ������з�Ӧ��
2N2O5(g)  4NO2(g)��O2(g)����H>0
4NO2(g)��O2(g)����H>0
T1�¶��µIJ���ʵ������Ϊ��
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
����˵������ȷ����(����)
A��500 s��N2O5�ֽ�����Ϊ2.96��10��3 mol/(L��s)
B��T1�¶��µ�ƽ�ⳣ��ΪK1��125,1 000 sʱת����Ϊ50%
C��������������ʱ��T2�¶��·�Ӧ��1 000 sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L����T1<T2
D��T1�¶��µ�ƽ�ⳣ��ΪK1��T3�¶��µ�ƽ�ⳣ��ΪK3����K1>K3����T1>T3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ���ǣ� ( )
A������ȼ��ʱ��ȫ���Ļ�ѧ��ת��Ϊ����
B����AgCl��Һ�м������ᣬKsp���
C�������ڼ�������R2-����Rһ������VIA��
D�������������ٵĽ���Ԫ�أ�һ����������������Ľ���Ԫ�ػ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����2013���������ҹ��ж����������������Χ����ʱ������������������ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס���
��1������̿�ɴ���������Ⱦ��NO����2 L�ܱ������м���NO�ͻ���̿�������ʣ�����������E��F�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ������±���
|
T/�� n/mol | ����̿ | NO | E | F |
| ��ʼ | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
�ٽ���ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ ��
��������ӦT1��ʱ��ƽ�ⳣ��K1= ��
�۸���������Ϣ�жϣ��¶�T1��T2�Ĺ�ϵ�ǣ�����ţ� ��
a��T1��T2 b��T1��T2 c�����Ƚ�
 ��2�������ŷŵĵ��������̼�������ڴ��������¿ɷ�����Ӧ��
��2�������ŷŵĵ��������̼�������ڴ��������¿ɷ�����Ӧ��
2CO+2NO N2+2CO2 ��һ���Ϊ1L���ܱ��ݻ��У�����0.40mol��CO��0.40mol��NO ����Ӧ��N2�����ʵ���Ũ�ȵı仯�����ͼ��ʾ���ش��������⡣

�ټ���ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(N2)= ��
���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱN2��Ũ��ԼΪ
0.25 mol/L����������ͼ�л�����5����ĩ����ƽ��ʱN2Ũ�ȵı仯���ߡ�
(3)ֱ���ŷ�úȼ�ղ������������������صĻ������⡣
��úȼ�ղ����������������������һ�������£���CH4��ԭNOX�������������������Ⱦ��
 ���磺CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g)�� ��H����867 kJ/mol
���磺CH4(g)+2NO2(g)��N2(g)��CO2(g)+2H2O(g)�� ��H����867 kJ/mol
2NO2(g) N2O4(g) ��H����56.9 kJ/mol
д��CH4��ԭN2O4(g)����N2��H2O(g)���Ȼ�ѧ����ʽ ��
�ڽ�ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷ�Ŀ�ġ�ͨ���˹�������ã���CO2��H2OΪԭ
�Ͽ����Ʊ�HCOOH��O2����������ÿ����1.0m3 CO2ת�Ƶĵ�����Ϊ ����
�۳����£�0.1mol/L��HCOONa��Һ��pHΪ10����HCOOH�ĵ��볣��Ka = ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij������ԭ��Ӧ���з�Ӧ��������ﹲ���֣�NO��FeSO4��Fe(NO3)3��H2O��HNO3��Fe2(SO4)3������HNO3Ϊ��Ӧ����������ԭ��Ӧ�еĻ�ԭ��Ϊ (�� ��)
A��NO B��FeSO4 C��Fe(NO3)3 D��Fe2(SO4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬһ��Һ�У�����NH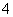 ��I����Ba2����Cl�������ӣ������Һ���ܵ�pH�ͽ�����
��I����Ba2����Cl�������ӣ������Һ���ܵ�pH�ͽ�����
A��pH��1��ϡ����Ϊ���� B��pH��3������Ϊ����
C��pH��8������������ҺΪ���� D��pH��12����ˮΪ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com