
【题目】常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
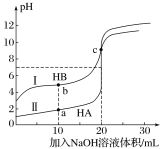
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
【答案】A
【解析】
A、中和反应是放热反应,温度越高水的离子积常数越大,即水电离的c(H+)·c(OH-)变大,故A错误;
B、由图可知,0.1mol·L-1HA的溶液的pH=1,说明HA为强酸,而0.1mol·L-1HB的溶液的pH>1,说明HB为弱酸,HB的酸性比HA的酸性弱,即HB的电离程度小于HA的电离程度,所以B选项是正确的;
C. V=10mL时,一半的酸被中和,所以所得溶液为等物质的量浓度的HB和NaB,存在物料守恒得:c(HB)+c(B-)=2c(Na+),所以C选项是正确的;
D. V=20mL时,酸碱恰好完全反应,得到等物质的量浓度的NaA和NaB溶液,由于B-离子会发生水解,则有c(A-)>c(B-),所以D选项是正确的。
故选A。


科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2(不溶于水和酸)、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
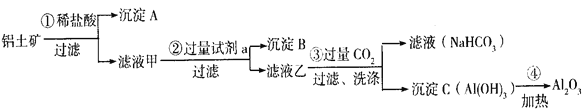
(1)沉淀A、B的成分分别是__________、__________;步骤②中的试剂a是__________;(以上均填化学式)
(2)试写出步骤③中发生反应的离子方式__________、__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___。
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___。

(4)已知高碘酸有两种形式,化学式分别为H5IO6(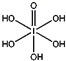 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO![]() 的VSEPR模型为__。
的VSEPR模型为__。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为__。
②一定条件下,Cu2O比CuO更稳定的原因是__。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体的边长为__pm。(用含ρ、NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(g)+Y(g)![]() 2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是
2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是

A.加入催化剂B.增大压强
C.降低温度D.保持容器体积不变,冲入He气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是

A. 该装置为原电池,b为原电池的负极
B. 中间室Na+移向右室,Cl-移向左室,a极区溶液的pH减小
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D. b电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.隔绝空气高温加热生物质,通过热化学转换可产生可燃性气体
B.光![]() 电转换的途径必定是发生了化学反应
电转换的途径必定是发生了化学反应
C.开发太阳能、氢能、核能、天然气等新能源可以减少霾的产生
D.植物秸秆发酵制沼气是在有氧条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
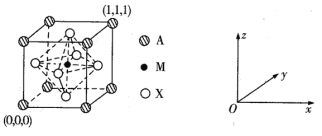
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com