
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
②CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是____,反应进行程度最大的是_____。
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充_________(填化学式)。

②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
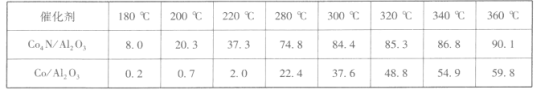
分析上表数据可知:_____(填化学式)的催化性能更好。
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
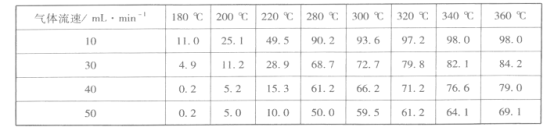
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率____(填“增大”或“减小”),其可能的原因是_________________________________。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是____,已知初始反应气体中V(H2):V(CO2) =4:l,估算该温度下的平衡常数为 ___________(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_________________________________。(已知Co的性质与Fe相似)
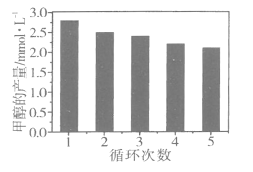
【答案】② ④ H2 Co4N/Al2O3 减小 气流流速加快,导致反应物与催化剂接触时间不够 360℃  反应产生的甲酸腐蚀催化剂,使催化剂活性降低
反应产生的甲酸腐蚀催化剂,使催化剂活性降低
【解析】
(1)在温度、压强一定的条件下,反应总是向△G<0的方向进行,由此判断。
(2)①分析反应过程图,CO2、O2、H2O属于循环过程中始终在循环过程中的,而H2属于循环过程中加入的,由此可知正确答案;
②分析表中数据,在相同温度下,对比不同催化剂时CO2的转化率可选择出催化性能更好的催化剂;
③分析表中数据,在温度不变的情况下,气流速度增大,CO2的转化率逐渐降低,据此分析原因;
④分析表中数据,大部分数据显示,在气流速度不变的情况下,CO2的转化率随着温度的增大而逐渐增大,但增大的幅度在逐渐减小,故在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是360℃,根据此时CO2的转化率,计算该温度下的平衡常数;
(3)由图可知,随着Co/C催化剂循环次数的增多,甲醇的产量逐渐降低,说明该催化剂在循环过程中受到一定程度的影响,结合产物的性质进行分析;
(1)分析四个反应,根据在温度、压强一定的条件下,反应总是向△G<0的方向进行,反应的△G越小反应进行程度越大,反之反应进行的程度就越小,故上述化学反应中反应进行程度最小的是②,反应进行程度最大的是④。答案为:②;④;
(2)①分析循环图,只有H2需不断补充,答案为:H2;
②对比表中的数据,在相同温度下,催化剂为Co4N/Al2O3时,CO2的转化率更大,答案为:Co4N/Al2O3;
③分析表中数据,温度不变时,随着气体流速的逐渐增大,CO2的转化率逐渐减小,可能是气体流速过快,来不及和催化剂充分接触,导致CO2的转化率减小。答案为:减小;气流流速加快,导致反应物与催化剂接触时间不够;
④分析表中数据,大部分数据表明,在320℃至360℃时,气体流速不变的情况下,CO2的转化率的增大幅度在逐渐减小,由此可知Sabatier反应最可能达到化学平衡状态的温度是360℃,结合题中所给信息,选择气体流速为10mL·min-1时CO2的转化率进行计算。
已知初始反应气体中V(H2):V(CO2) =4:l,根据在密闭容器里,全部由气体参与的反应中,压强、温度不变时,气体的体积比等于物质的量之比,可知V(H2):V(CO2) = n(H2):n(CO2)=4:l,设初始气体中H2的物质的量为4mol,CO2的物质的量为1mol,则有:
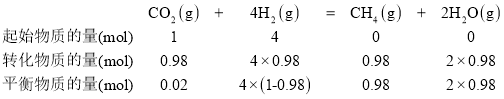
在密闭容器中,全部由气体参与的反应中,平衡时气体的物质的量之比=气体物质的量浓度之比,可知该温度下,该反应的平衡常数K=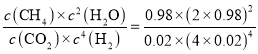 。答案为:360℃;
。答案为:360℃; ;
;
(3)根据题中催化剂循环次数和甲醇产量的关系:催化剂的循环次数越多,甲醇的产量逐渐降低,说明催化剂一定程度受到了其他物质的影响,结合题给信息:用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。又已知Co的性质与Fe相似,说明甲酸可与催化剂中的Co进行反应,故催化剂的活性降低,进而影响甲醇的产量,答案为:反应产生的甲酸腐蚀催化剂,使催化剂活性降低。


科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF![]() H++F-,HF+F-
H++F-,HF+F-![]() HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
A.c(HF)+c(F-)=2.0amol·L-1
B.c(F-)>c(HF)时,溶液一定呈碱性
C.随着溶液pH增大,![]() 不断增大
不断增大
D.25℃时,HF的电离常数Ka=10-3.45
查看答案和解析>>
科目:高中化学 来源: 题型:
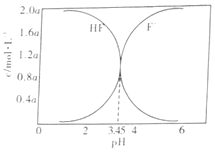
【题目】下图是2SO3(g)![]() 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法写出下列物质名称或结构简式或者对应的化学方程式:
(1) ______________________________。
______________________________。
(2)实验室制取乙炔的化学方程式为:_________________________________________。
(3)乙醇的消去反应:________________________________________________;
(4)3-甲基-1-丁烯:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
FeO(s)+H2(g)的平衡常数为K2。测得在不同温度下,K1、K2值如下:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)若500 ℃时进行反应①,CO2的转化率为_______________。
(2)900 ℃时进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=______________。
H2O(g)+CO(g),其平衡常数K3=______________。
(3)反应②的焓变ΔH____________(填“>”、“<”或“=”)0。
(4)700 ℃时反应②达到化学平衡,要使该平衡向正反应方向移动,当其他条件不变时,可采取的措施有___________________________________。
A.缩小容器容积 B.加入更多的水蒸气
C.升高温度至900 ℃ D.使用合适的催化剂
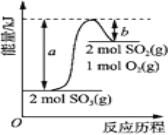
(5)下列图像符合反应①的是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________。利用反应6NO2+ 8NH3![]() 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a 体系压强保持不变 b 混合气体颜色保持不变
c SO3和NO的体积比保持不变 d 每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K=__________。
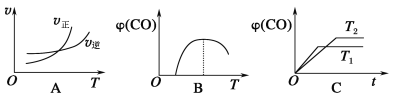
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
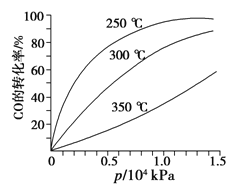
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。

该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com