
MnO2的一些性质或用途如图,下列说法正确的是 ( )
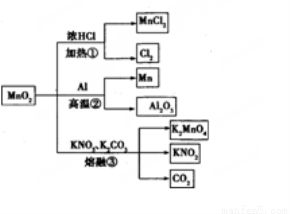
A.①、②、③三个反应中MnO2均作氧化剂
B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12
C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D.反应③中K2CO3和KNO3的化学计量数均为1
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32-
B.0.1 mol/LFeCl3溶液:K+、NH4+、I-、SCN-
C.0.1 mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、I-、NO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应
① H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
② 2H2S(g)+SO2(g)=S2 (g)+2H2O(g) △H2
③ H2S(g)+O2(g)=S(g)+H2O(g) △H3
④ 2S(g) =S2(g) △H4
则△H4的正确表达式为
A.△H4=(△H1+△H2-3△H3)B.△H4=(3△H3-△H1-△H2)
C.△H4=(△H1+△H2-3△H3) D.△H4=(△H1-△H2-3△H3)
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为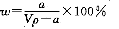
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中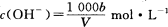
D.溶质的物质的量浓度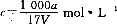
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
你认为下列数据可信的是 ( )
A. 某雨水的pH为5.6
B.某澄清石灰水的浓度是2.0 mol/L
C.某胶体粒子的直径是160 nm
D.某常见气体的密度为1.8 g/cm3
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 |
|
|
| ① | ② | ③ | ④ |
|
三 | ⑤ | ⑥ | ⑦ |
|
| ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为_____>_____>____ (填元素符号),判断的实验依据是_______(写出一种)。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
同一主族的两种元素的原子序数之差不可能的是
A.16 B.26 C.36 D.46
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:实验题
(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
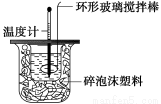
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_________________________
________________________________________________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
|
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=_______________________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com