
| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
分析 A、氨气溶于水生成一水合氨,不能用于杀菌、消毒、漂白;
B、次氯酸具有强氧化性,能用于杀菌、消毒、漂白;
C、二氧化硫具有漂白性,能使有色物质褪色;
D、过氧化钠具有强氧化性,具有漂白性.
解答 解:A、氨气本身没有漂白性,溶于水后与水反应生成一水合氨,是一元弱碱溶液显碱性,不具有漂白性,故A选;
B、次氯酸具有具有强氧化性,能使某些染料和有机色素褪色,具有漂白性,故B不选;
C、SO2可与有机色素发生化合反应而使有色物质褪色,表现了二氧化硫的漂白作用,故C不选;
D、Na2O2的水溶液可生成具有漂白性的H2O2,均具有强氧化性,能把有机色素氧化为无色物质,具有漂白性,故D不选;
故选A.
点评 本题考查物质的漂白性,掌握高中常见的具有漂白性的物质,并理解其漂白原理,如活性炭、过氧化钠、二氧化硫、次氯酸等,题目较简单.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
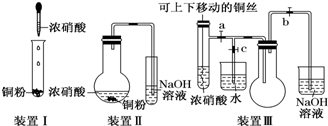
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
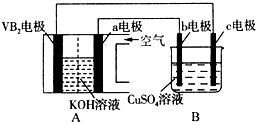 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
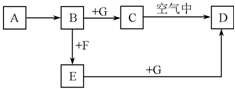 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
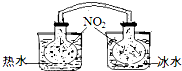 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com