
【题目】实验室需要0.1mol/L NaOH溶液400mL。根据溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是__________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1cm~2cm处
(3)关于容量瓶的四种叙述:
①是配制准确浓度溶液的仪器;
②不宜贮存溶液;
③不能用来加热;
④使用之前要检查是否漏水。
这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______。
(5)下面操作造成所配溶液浓度偏高的是__________(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D. 摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
【答案】b、d 500mL容量瓶、胶头滴管、量筒 B C A F E D A 2.0 A、C
【解析】
(1)配制该溶液时需要烧杯、玻璃棒、500mL容量瓶,胶体滴管,量筒等,不会使用分液漏斗和漏斗,选b、d。(2)配制溶液的步骤为溶解,转移,洗涤,定容,摇匀,所以顺序为B C A F E D。 (3)容量瓶是配制准确浓度的溶液的仪器,不能储存溶液,不能加热,使用前要检查是否漏水,故选A。(4)需要的氢氧化钠固体的质量为0.1mol/L×0.5L×40g/mol= 2.0g 。 (5) A.溶解后溶液没有冷却到室温就转移,最后配制的溶液的体积变小,则浓度变大,故正确;B.转移时没有洗涤烧杯、玻璃棒溶质有损失,浓度变小,故错误;C.向容量瓶加水定容时眼睛俯视液面,则溶液的体积变小,浓度变大,故正确;D. 摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,则浓度变小,故错误。故选A、C。


科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12a/b
②该氯原子的摩尔质量是aNA g
③m g该氯原子的物质的量为m/(aNA)mol
④a g该氯原子所含的电子数为17 mol
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.氢氧化钠的摩尔质量是40g
B.1mol氢氧根离子的质量是17g
C.1mol氮的质量是14g/mol
D.氩气的摩尔质量就是它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.2mol/L草酸溶液中逐滴加入等浓度的NaOH溶液,溶液中各微粒的物质的量与混合溶液pH的关系如图所示,下列说法正确的是

A. 当V(NaOH溶液)<10mL时,溶液中可能存在:c(Na+)=2c(C2O42-)+c(HC2O4-)
B. 当V(NaOH溶液)=10mL时,溶液中水的电离程度比纯水大
C. 当V(NaOH溶液)=15mL时,溶液中存在: c(Na+)>c(HC2O4-)>c(C2O42-)
D. 当V(NaOH溶液)=20mL时,溶液中存在:c(OH-)=2c(H2C2O4)+c(H+)+c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示

(1)溴化钠晶体比氯化钠晶体晶格能________(填“大”或“小”),主要原因是_____。
(2)氧化镁晶体比氯化钠晶体晶格能大,主要原因是_________________________________。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是________。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.

(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
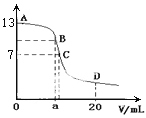
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com