
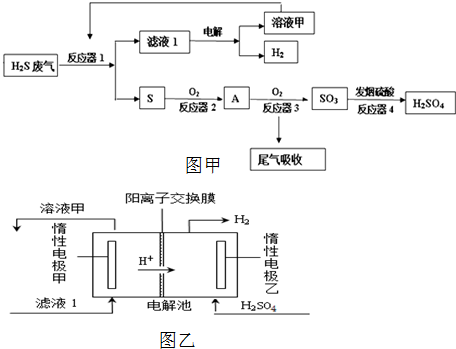
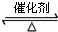 2SO3,
2SO3, 2SO3;
2SO3;
| ||
| ||


科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
A.x的转化率变小 B.(a+b)>(c+d)
C.z的体积分数变大 D.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、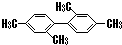 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol有机物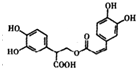 一定条件下能和7molNaOH反应. 一定条件下能和7molNaOH反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、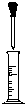 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 |
| B、金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 |
| C、探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 |
| D、可用热氢氧化钠溶液鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) |
查看答案和解析>>
科目:高中化学 来源: 题型:
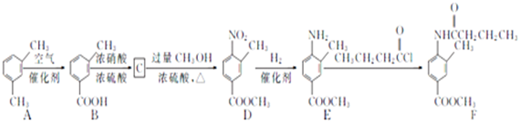
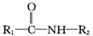 在一定条件下可水解为
在一定条件下可水解为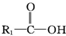 和R2-NH2,则F在强酸和长时间加热条件下发生水解反应,水解产物的结构简式为
和R2-NH2,则F在强酸和长时间加热条件下发生水解反应,水解产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
A、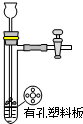 装置用于Na2SO3和浓H2SO4反应制取少量的SO2气体 |
B、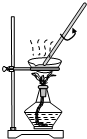 装置用于灼烧CuSO4?5H2O |
C、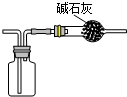 装置用于收集氯气并防止污染空气 |
D、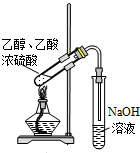 装置用于实验室制备少量乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用饱和溴水除去苯中的苯酚 |
| B、丙烯加聚时可形成顺反两种聚合物 |
| C、常压下的沸点:1-丙醇>乙醇>丙烷 |
| D、蔗糖及其水解产物均能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化钙用作儿童食品的干燥剂存在安全隐患 |
| B、聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| C、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| D、绿色化学的核心是利用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com