
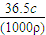

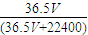

 进行公式变形计算ω;
进行公式变形计算ω; ,分子为溶液的质量,分母为溶液的体积,可得该表达式中溶液的体积等于HCl的体积与水的体积之和,据此判断;
,分子为溶液的质量,分母为溶液的体积,可得该表达式中溶液的体积等于HCl的体积与水的体积之和,据此判断; 计算HCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据溶质质量分数=
计算HCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据溶质质量分数= ×100%计算;
×100%计算; 计算HCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,利用V=
计算HCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,利用V= 计算溶液的体积,再根据c=
计算溶液的体积,再根据c= 计算HCl物质的量浓度.
计算HCl物质的量浓度. 可得,ω=
可得,ω= ,故A正确;
,故A正确; ,分子为溶液的质量,分母为溶液的体积,可得该表达式中溶液的体积等于HCl的体积与水的体积之和,实际溶液的体积不等于气体与水的体积之和,故B错误;
,分子为溶液的质量,分母为溶液的体积,可得该表达式中溶液的体积等于HCl的体积与水的体积之和,实际溶液的体积不等于气体与水的体积之和,故B错误; =
= mol,HCl的质量为
mol,HCl的质量为 mol×36.5g/mol=
mol×36.5g/mol= g,1L水的质量为1000mL×1g/mL=1000g,故HCl质量分数为
g,1L水的质量为1000mL×1g/mL=1000g,故HCl质量分数为 ×100%=
×100%= ×100%,故C正确;
×100%,故C正确; =
= mol,HCl的质量为
mol,HCl的质量为 mol×36.5g/mol=
mol×36.5g/mol= g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为(
g,1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为( +1000)g,溶液的体积为
+1000)g,溶液的体积为 =
= L,故所得溶液的物质的量浓度为
L,故所得溶液的物质的量浓度为 =
= mol/L,故D正确;
mol/L,故D正确;

科目:高中化学 来源: 题型:阅读理解
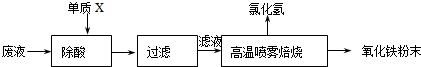
| ||
| ||
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, 加入足量的3mol?L-1H2SO4,充分振荡 加入足量的3mol?L-1H2SO4,充分振荡 |
样品全部溶解 样品全部溶解 |
| 步骤2. 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 |
试管中出现红色固体,说明试样中有CuO 试管中出现红色固体,说明试样中有CuO |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| VNA |
| n |
| VNA |
| 2000 |
| 20+9a |
| 2000 |
| 20+9a |
| b |
| 5.1 |
| b |
| 5.1 |
查看答案和解析>>
科目:高中化学 来源:北京市石景山区2010年高三一模(理科综合)化学部分 题型:选择题
下列说法正确的是 ( )
A.某温度时,pH=6的纯水,含10-6×6.02×1023个OH-
B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023
C.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数必为0.5×6.02×1023
D.V L a mol/L的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知某氢氧化钠溶液V L中含有n个氢氧根离子,可求出此溶液的_______,是_______。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的___________,为________________。
(3)已知标准状况下氯化氢气体的溶解度为500,则可求出标准状况下氯化氢饱和溶液的_________________,为__________________。(设水在标准状况下的密度为1 g·cm-3)
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得白色固体b g,则可求出原氯化铝溶液的__________________,为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com