
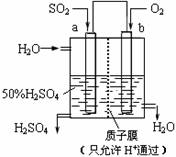
| A. | a为正极,b为负极 | |
| B. | 生产过程中a电极质量减轻 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
分析 该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,负极反应式为SO2+2H2O-2e-=SO42-+4H+,正极反应式为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,所以a是负极、b是正极,故A错误;
B.a电极上电极反应式为SO2+2H2O-2e-=SO42-+4H+,生成阴阳离子,所以a电极质量不变,故B错误;
C.a是负极、b是正极,所以电子从a极流向b极,故C错误;
D.负极上二氧化硫失电子发生氧化反应,电极反应式为SO2+2H2O-2e-=SO42-+4H+,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,根据元素化合价变化确定正负极,知道各个电极发生的反应及电子流向,难点是电极反应式的书写,题目难度中等.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
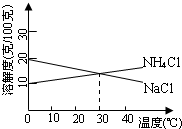 NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )| A. | 0℃时,饱和的NaCl和NH4Cl混合溶液中,NaCl的物质的量浓度是NH4Cl的2倍 | |
| B. | 30℃时,饱和的NaCl和NH4Cl混合溶液中,两者的物质的量浓度相等 | |
| C. | 通入的气体可能是NH3,控制在0~10℃结晶出NH4Cl | |
| D. | 通入的气体可能是CO2,控制在30~40℃结晶出NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验Ⅱ:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验Ⅲ:抽去中间玻璃片,瓶内没有任何现象 | |
| D. | 实验Ⅳ:BaCl2溶液变浑浊,品红溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中充入1mol N2和3mol H2可生成2mol NH3 | |
| B. | 改变条件不能改变可逆反应的限度 | |
| C. | 当某反应在一定条件下达到反应限度时即达到了化学平衡状态 | |
| D. | 当某反应达到限度时,反应物和生成物的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
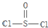 )是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.
)是一种很重要的化学试剂,可以作为氯化剂和脱水剂.氯化亚砜分子的几何构型是三角锥形;中心原子采取SP3杂化方式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应进行到平衡状态时,那么这个反应的正逆反应速率相等 | |
| C. | 平衡状态是一种静止的状态,因此反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤法 | B. | 萃取法 | C. | 分液法 | D. | 蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com