
熔融盐燃烧电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2混合气为阴极助燃气,制得在650℃下工作的燃料电池.完成有关的电池反应式:
阳极反应式:2CO+CO32-![]() 4CO2+4e-
4CO2+4e-
阴极反应式:________________________________________________.
总电池反应式:________________________________________________.
 能力评价系列答案
能力评价系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
熔融盐燃烧电池具有高的发电效率,因而受到重视,可用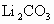 和
和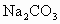 的熔融盐混合物作电解质,CO为阳极燃气,空气与
的熔融盐混合物作电解质,CO为阳极燃气,空气与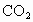 混合气为阴极助燃气,制得在650℃下工作的燃料电池.完成有关的电池反应式:
混合气为阴极助燃气,制得在650℃下工作的燃料电池.完成有关的电池反应式:
阳极反应式: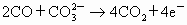
阴极反应式:__________________________.
总电池反应式:________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:022
熔融盐燃烧电池具有高的发电效率,因而受到重视,可用 和
和 的熔融盐混合物作电解质,CO为阳极燃气,空气与
的熔融盐混合物作电解质,CO为阳极燃气,空气与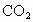 混合气为阴极助燃气,制得在650℃下工作的燃料电池.完成有关的电池反应式:
混合气为阴极助燃气,制得在650℃下工作的燃料电池.完成有关的电池反应式:
阳极反应式:
阴极反应式:__________________________.
总电池反应式:________________________.
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省甘谷一中高三上学期第一次检测考试理综化学试卷(带解析) 题型:填空题
(14分)水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的炭制得:C (s) + H2O(g) CO (g) +H2 (g) △H=+131kJ?mol-1
CO (g) +H2 (g) △H=+131kJ?mol-1
⑴T温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
| I | 0.06 | 0.60 | 0.10 | v正=v逆 |
| II | 0.06 | 0.50 | 0.40 | ① |
| III | 0.12 | 0.40 | 0.80 | v正<v逆 |
| IV | 0.12 | 0.30 | ② | v正=v逆 |
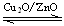 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向 移动,减小压强则平衡向 移动,降低温度则平衡向 移动(填左,右,不)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com