
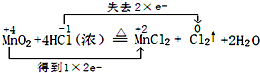 ��
������ ��1����Ӧ��MnԪ�ػ��ϼ۽��ͣ����ϼ���+4�۽��͵�+2�ۣ�ClԪ�ػ��ϼ����ߣ���-1�����ߵ�0�ۣ����ϼ�����ֵ=���ϼ۽���ֵ=ת�Ƶ�������
��2����Ӧ��MnԪ�ػ��ϼ۽��ͱ���ԭ��ClԪ�ػ��ϼ����ߣ���HClΪ��ԭ����
��3��n��Cl2��=$\frac{2.24L}{22.4L/mol}$=0.1mol����Ϸ�Ӧ�Ļ�ѧ����ʽ����ԭ���غ���㣮
��� �⣨1����Ӧ��MnԪ�ػ��ϼ۽��ͣ����ϼ���+4�۽��͵�+2�ۣ�ClԪ�ػ��ϼ����ߣ���-1�����ߵ�0�ۣ�������ԭ��Ӧ�е�ʧ������Ŀ��ȣ�����Ϊ���ϼ�������������ȣ��ɱ�ʾΪ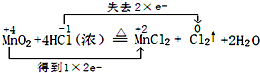 ����
����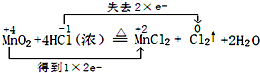 ��
��
��2����Ӧ��MnԪ�ػ��ϼ۽��ͱ���ԭ��ClԪ�ػ��ϼ����ߣ���HClΪ��ԭ�����ʴ�Ϊ��HCl��Mn��
��3��n��Cl2��=$\frac{2.24L}{22.4L/mol}$=0.1mol��
MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O
87g 1mol
m 0.1mol
m=8.7g��
�ָ�����ԭ���غ㣬��Ӧ����Һ��Cl-���ʵ���Ũ����$\frac{12��0.1-0.1��2}{0.1}$=10mol/L
����Ҫ����MnO28.7g����Ӧ����Һ��Cl-���ʵ���Ũ����10mol/L��
���� ���⿼��������ԭ��Ӧ����Ŀ�ѶȲ���ע�����Ԫ�ػ��ϼ۵ı仯�Լ���Ӧ�ķ���ʽ���м��㼴�ɣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2�ĵ���ʽ��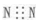 | |
| B�� | ������Ϊ53��������Ϊ78�ĵ�ԭ�ӣ�${\;}_{53}^{131}$I | |
| C�� | S2-�Ľṹʾ��ͼ��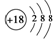 | |
| D�� | ��ϩ�ķ���ʽ��CH2=CH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
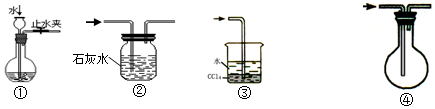
| A�� | װ�âٿ����ڼ��װ�õ������� | |
| B�� | װ�âڿ����ڳ�ȥCO�л��е�����CO2 | |
| C�� | װ�âۿ����ڰ�ȫ���ռ�������ˮ���Ȼ����������� | |
| D�� | װ�âܿ������ſ����ռ�CO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʼ˲��HCl��H2SO4��CH3COOH��Ӧ������� | |
| B�� | ����Ӧ����ʱCH3COOH�зų�H2��������� | |
| C�� | �ռ���ͬ�����H2��CH3COOH����ʱ��� | |
| D�� | ����Ӧ����ʱHCl��H2SO4�ռ���H2�������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol•L -1CaCl2����Һ��SO42-��Na+��NO 3-��Cl- | |
| B�� | ʹ��̪���ɫ����Һ��NH 4+��K+��SO42-��NO 3- | |
| C�� | ��������Һ��Mg 2+��Na+��Cl-��SO4 2- | |
| D�� | �ں��д���HCO 3-����Һ�У�Na +��NO 3-��Cl-��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2SO4 | B�� | CuSO4 | C�� | Fe2��SO4��3 | D�� | AgNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˢ��ʱ�ʵ�ʹ�ú��������ܹ�Ԥ��ȣ�� | |
| B�� | ȱп���˿��Է�������п�ǽ�����������п�Ȳ�п | |
| C�� | ������ȱ����ʹ���˻���״���״� | |
| D�� | ��Ȼ������ˮ��IJ��ﶼ�Ǧ�-������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�1.0 L 1.0 mol•L-1KAlO2��Һ�к��е���ԭ����Ϊ2 NA | |
| B�� | 7.8 g Na2O2�����к��е���������Ϊ0.2 NA | |
| C�� | ��״���£����Ϊ2.24 L��CO2��SO2�Ļ�������к��е���ԭ����Ϊ0.2 NA | |
| D�� | 0.1 mol Cl2�μ�������ԭ��Ӧ��ת�Ƶĵ�����Ŀһ����0.2 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
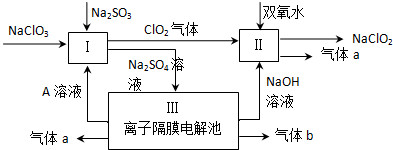
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com