
下列变化必须加入氧化剂才能实现的是
A.Cr2O72- → CrO42- B.HNO3 → NO2
C.SiO2 → Si D.CH3CH2OH → CH3CHO
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
不具有放射性的同位素称之为稳定同位素,稳定同位素分析法近20年来在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是( )
A.34S原子核内中子数为16
B.1H O和1H
O和1H O的相对分子质量不同
O的相对分子质量不同
C.13C和15N原子核内的质子数相差2
D.2H+结合OH-的能力比1H+的更强
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温 度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)<M(乙),则气体的压强:甲>乙
C.若M(甲)>M(乙),则气 体的摩尔体积:甲<乙
体的摩尔体积:甲<乙
D.若M(甲)<M(乙),则的分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图象表达正确的是( )
|
| A. |
等质量锌粉与足量盐酸反应 |
|
| B. |
氢气与氧气反应中的能量变化 |
|
| C. |
气态氢化物沸点 |
|
| D. |
催化反应与非催化反应过程中的能量关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
已知:
①CH4(g)+H2O(g)=CO(g)+3H2(g)△H1=+206.2kJ•mol﹣1
②CH4(g)+O2(g)=CO(g)+2H2(g)△H2=﹣35.4kJ•mol﹣1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H3=+165.0kJ•mol﹣1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为 .
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 .
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3]Ac•CO△H<0,[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 .
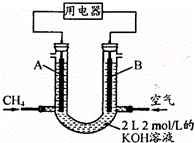
(4)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为 .
②44.8L<V≤89.6L时,负极电极反应为 .
③V=67.2L时,溶液中离子浓度大小关系为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X完全燃烧的产物只有二氧化碳和水,元素组成分析发现,该物质中碳元素的质量分数为60.00%,氢元素的质量分数为13.33%,它的核磁共振氢谱有4组明显的吸收峰。下列关于有机物X的说法不正确的是
A.含有C、H、O三种元素
B.相对分子质量为60
C.分子组成为C3H8O
D.结构简式为CH3CHOHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
|
图1 |
图2 |
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因: 。
(2)图2中,钢闸门C做 极。用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极反应式为 ,检测该电极反应产物的方法是 。
| | |
图3 图4
(3)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
① E为该燃料电池的 极(填“正”或“负”)。F电极上的电极反应式为 。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因 。
(4)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
① N电极上的电极反应式为 。
② 若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应P(g)+Q(g) M(g)+N(s)△H<0,达到平衡时,下列说法正确的是
M(g)+N(s)△H<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡不移动 B.加入催化剂,M的产率增大
C.增大c(P),P的转化率增大 D.降低温度,Q的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2SO3 2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2 mol SO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
2SO2+O2,在起始时体积相同的容器A和B中,同时分别充入2 mol SO3(两容器装有催化剂)。在反应过程中,A保持温度和容积不变;B保持温度和压强不变。回答下列问题:
(1)反应达平衡所需时间A B(大于;等于;小于);达平衡时SO3的转化率
A B(大于;等于;小于)。
(2)若平衡后,向A、B中分别充入惰性气体, 容器的平衡将向 方向移动;若平衡后,向A、B中分别充入等物质的量SO3,重新达平衡时,两容器中的SO3转化率变化情况是(填变大、变小、不变)A ,B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com