
| A.2 g | B.3 g |
| C.3.5 g | D.4.5 g |
科目:高中化学 来源:不详 题型:单选题
| A.0.125 mol | B.0.15 mol | C.0.2 mol | D.0.1 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三种浓酸:HNO3、H2SO4、HCl |
| B.四种黑色粉末:FeO、Fe、CuO、C |
| C.四种无色溶液:NaCl、NaOH、KOH、KCl |
| D.四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
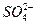 ,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式A.Ba2++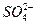 ====BaSO4↓ ====BaSO4↓ |
| B.Al3++3OH?====Al(OH)3↓ |
C.Al3++4OH-==== 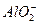 +2H2O +2H2O |
D.2Al3++3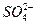 +3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓ +3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓ |
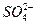 +2Ba2++3OH-====2BaSO4↓+Al(OH)3↓
+2Ba2++3OH-====2BaSO4↓+Al(OH)3↓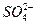 +2Ba2++4OH-====2BaSO4↓+
+2Ba2++4OH-====2BaSO4↓+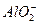 +2H2O
+2H2O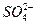 完全沉淀时的离子方程式为_________。
完全沉淀时的离子方程式为_________。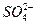 )为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为 mol·L-1(用a、b表示)。
)为a mol·L-1,当滴加完等体积的b mol·L-1 KOH溶液时,反应过程中生成的沉淀恰好完全溶解,则原混合溶液中K+的物质的量浓度为 mol·L-1(用a、b表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| X | BaCl2 | HCl | NaOH | FeCl3 |
| Y | H2SO4 | NaAlO2 | MgCl2 | NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(4n-m) mol | B.(4m-n) mol |
| C.(n-3m)mol | D.(3m-n)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
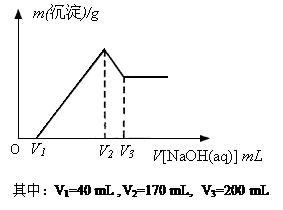
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com