
【题目】(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
【答案】(1)①H2A![]() H++HA-②>AC
H++HA-②>AC
(2)①CO32-+H2O![]() HCO3-+OH- Kh=
HCO3-+OH- Kh= ![]()
②10③HCO3-+2H2CO3
④3CO32-+2Al3++6H2O=2Al(OH)3↓+3CO2↑
(3)c(NO3-)>c(NO2-)>c(CH3COO-)bc
(4)①酸(1分)HSO3-中存在:HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() HSO3-+OH-
HSO3-+OH-
HSO3-电离程度大于其水解程度(2分)②AB
【解析】
试题分析:
(1)①由于溶液存在H2A,说明H2A是二元弱酸,其电离方程式:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-;②当NaHA与NaOH等物质的量反应后生成Na2A,共0.02mol,由于A2-水解使得溶液显碱性,pH>7。A.可得溶液中离子浓度的大小顺序为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故A正确;B.根据质子守恒可得:c(H+)+c(HA-)+2c(H2A)=c(OH-),故B错误;C.根据物料守恒可得,c(A2-)+c(HA-)+c(H2A)=1mol·L-1,故C正确;D.根据电荷守恒可得,2c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+),故D错误;故选AC。
H++A2-;②当NaHA与NaOH等物质的量反应后生成Na2A,共0.02mol,由于A2-水解使得溶液显碱性,pH>7。A.可得溶液中离子浓度的大小顺序为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故A正确;B.根据质子守恒可得:c(H+)+c(HA-)+2c(H2A)=c(OH-),故B错误;C.根据物料守恒可得,c(A2-)+c(HA-)+c(H2A)=1mol·L-1,故C正确;D.根据电荷守恒可得,2c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+),故D错误;故选AC。
(2)①碳酸钠是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32-+H2O![]() HCO3-+OH-;Kh=
HCO3-+OH-;Kh=![]() ;
;
②Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,Kh=![]() =2×10-4mol/L,c(OH-)=1×10-4mol/L,c(H+)=1×10-10mol/L,所以溶液的pH=10;
=2×10-4mol/L,c(OH-)=1×10-4mol/L,c(H+)=1×10-10mol/L,所以溶液的pH=10;
③根据碳原子的物料守恒得,c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L,根据溶液中电荷守恒得:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),c(Na+)=0.2mol/L,所以c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3);
④向 Na2CO3溶液中加入明矾,因CO32-和Al3+发生双水解反应,会产生沉淀和气体,反应的离子方程式为3CO32-+2Al3++6H2O=2Al(OH)3↓+3CO2↑;
(3)根据盐类水解规律,越弱越水解,所以CH3COO的水解程度大于NO2-,故离子浓度大小是c(NO3-)>c(NO2-)>c(CH3COO-);因为CH3COO的水解程度大于NO2-,所以溶液A的pH小于溶液B的pH。 a.向溶液A中加适量水(使A的pH减小),b.向溶液A中加适量NaOH(使A的pH增大),c.向溶液B中加适量水(使B的pH减小),d..向溶液B中加适量NaOH (使B的pH增大),只有bc满足题意。
(4)①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性,亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度。故答案为:酸性;HSO3-存在HSO3-![]() H++SO32- 和HSO3-+H2O
H++SO32- 和HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度大于水解程度。②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.A、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故正确.B、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故正确.C、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故错误;故选AB。
H2SO3+OH-,HSO3-的电离程度大于水解程度。②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.A、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故正确.B、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故正确.C、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故错误;故选AB。


科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A.灼热的炭与CO2反应 B.铝片与稀H2SO4反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几种离子
![]()
己知:铵盐受热易分解,A、B、C、D、E是由它们组成的五种可溶于水的固体(每种离子只能用一次),分别取它们进行实验,结果如下:
①将D与E的溶液混合加热,产生刺激性气味且能使湿润的红色石蕊试纸变蓝的气体;
②将B与E的溶液混合,产生白色沉淀,向该沉淀中加入足量的稀硝酸,沉淀部分溶解;
③向一定量的E溶液中逐滴加入C溶液,先无明显现象,后来产生白色沉淀,且该沉淀可溶于A溶液;
④D固体在一定温度下可以分解为水和另外两种均为空气主要成分的气体单质。
根据上述信息回答下列问题:
(1)根据以上条件推断并写出下列物质的化学式:
A________;B________;C________;D________;E________;
(2)写出A溶液与E溶液恰好完全反应至溶液呈中性的离子方程式___________。
(3)写出D固体分解的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境、保护地球已成为人类共同的呼声。下列措施不利于保护环境的是
A. 积极推广使用新型环保装饰材料
B. 发展清洁煤技术,开展煤的综合利用
C. 控制工业废水和生活污水的排放,改善水体质量
D. 关闭垃圾焚烧处理厂,生活垃圾和工业垃圾全部就地填埋处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含 SO32-、Fe2+、Br-、I-各 0.1 mol 的溶液中通入标准状况下的 Cl2,通入 Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
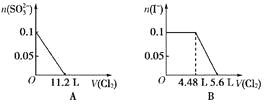
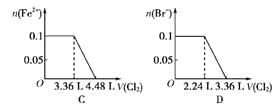
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述,错误的是( )
A.第IA族元素全部是金属元素
B.过渡元素全是金属元素
C.第ⅦA族元素是同周期中非金属性最强的元素
D.在元素周期表中金属与非金属的分界线附近可以寻找制造半导体的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 物质燃烧不一定是放热反应
B. 放热反应不需要从外界吸收任何能量就能发生
C. 在一个确定的化学反应中,反应物总能量总是高于生成物总能量
D. 化学反应除了生成新的物质外,还伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com