
 A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| 4+1-3 |
| 2 |


科目:高中化学 来源: 题型:
| A、铝与盐酸反应 |
| B、NaOH和HCl反应 |
| C、Ba(OH)2?8H2O与NH4Cl的反应 |
| D、CaCO3受热分解为CaO和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、对硝基甲苯的结构简式为: |
| B、“地沟油”禁止食用,但可以用来制肥皂 |
| C、升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D、H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol不是氢气的燃烧热方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH=CH2 烯烃  |
B、 羧酸-COOH 羧酸-COOH |
C、 羧酸类-COOH 羧酸类-COOH |
| D、R-OH(R为链烃基) 醇类-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2CH3 |
| B、CH2=CHCH=CH2 |
| C、CH3CH2CH2OH |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
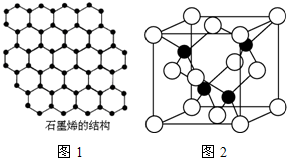
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
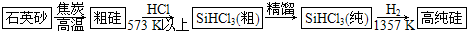
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com