
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol•L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
分析 实验一(1)根据仪器的用途选取仪器;
(2)根据NaOH的体积,第3次数据显然误差较大,舍去;另外三次所用NaOH平均体积为20 mL,代入计算;
实验二(1)部分电离的电解质是弱电解质;
(2)醋酸浓度越小,醋酸的电离程度越大.
解答 解:实验一(1)根据仪器的用途选取仪器,用胶头滴管定容,用250mL容量瓶配制溶液,
故答案为:胶头滴管;250 mL容量瓶;
(2)根据NaOH的体积,第3次数据显然误差较大,舍去;另外三次所用NaOH平均体积为:$\frac{20.05+20.00+19.95}{3}$mL=20 mL,
则氢氧化钠溶液平均浓度:$\frac{0.2000mol/L×0.02L}{0.02L}$=0.200 0 mol•L-1,
故答案为:0.200 0 mol•L-1;
实验二(1)孤立的看每次测量值,H+浓度远小于醋酸的浓度,说明醋酸不完全电离;联系起来看,浓度为0.100 0 mol•L-1、0.010 0 mol•L-1及0.001 0 mol•L-1的醋酸,pH变化值小于1,所以醋酸是弱电解质,
故答案为:0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1;
(2)以0.100 0 mol•L-1、0.010 0 mol•L-1醋酸为例,设0.100 0 mol•L-1的醋酸溶液体积为1 L,将其稀释至0.010 0 mol/L,体积变为10 L,两溶液中H+的物质的量分别为:10-2.88 mol、10-2.38 mol,可见溶液变稀,电离出的H+的物质的量增大,故说明醋酸的电离程度增大,
故答案为:增大.
点评 本题考查了弱电解质电离及实验探究,题目难度较大,明确弱电解质电离特点是解本题关键.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He分别含有1和2个质子 | |
| C. | ${\;}_{2}^{3}$He 和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{3}$He的最外层电子数为1,所以${\;}_{2}^{3}$He 具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
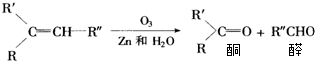
| A. |  | B. | 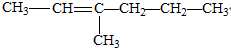 | ||
| C. | 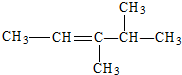 | D. | 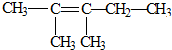 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
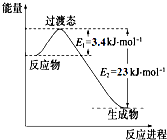 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 原子中核外电子排布的周期性变化是产生元素周期律的根本原因 | |
| D. | 核素就是同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、溴水 | B. | NaOH溶液、溴水 | ||
| C. | 高锰酸钾溶液、溴水 | D. | NaHCO3溶液、溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com