
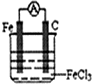
 ,
,

科目:高中化学 来源: 题型:
A、 和 和 是同一物质 是同一物质 |
| B、CH2=CH2和CH2=CH-CH3互为同系物 |
C、 和 和 互为同系物 互为同系物 |
D、 和 和 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(4)(3)(1)(2) |
| B、(3)(4)(2)(1) |
| C、(4)(2)(3)(1) |
| D、(4)(3)(2)(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 容量瓶 | 玻璃棒 | 药匙 | 量筒 | 胶头滴管 |
| 仪器 |  |
 |
 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f | g |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.查看答案和解析>>
科目:高中化学 来源: 题型:
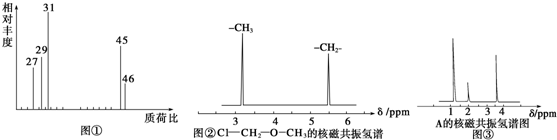
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com