
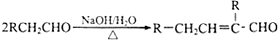 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下: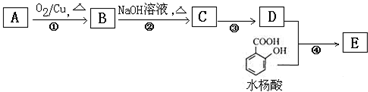
 ;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键;
;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键; 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、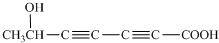 ;
; :
: 分析 一元醇A中氧的质量分数约为21.6%,设该饱和一元醇的化学式为CnH2n+2O,氧元素的质量分数=$\frac{16}{14n+2+16}$×100%=21.6%,则:n=4,且A中只有一个甲基,所以该一元醇是1-丁醇,在铜作催化剂、加热条件下,A被氧气氧化生成B丁醛,丁醛和氢氧化钠的水溶液发生反应生成 C,结合题给信息知,C的结构简式为: ,C反应生成D,D的相对分子质量是130,则C和氢气发生加成反应生成D,则D的结构简式为:CH3CH2CH2CH2CH(CH2OH)CH2CH3,D和邻羟基苯甲酸发生酯化反应生成E,E的结构简式为:
,C反应生成D,D的相对分子质量是130,则C和氢气发生加成反应生成D,则D的结构简式为:CH3CH2CH2CH2CH(CH2OH)CH2CH3,D和邻羟基苯甲酸发生酯化反应生成E,E的结构简式为: ,结合物质的结构和性质进行解答.
,结合物质的结构和性质进行解答.
解答 解:一元醇A中氧的质量分数约为21.6%,设该饱和一元醇的化学式为CnH2n+2O,氧元素的质量分数=$\frac{16}{14n+2+16}$×100%=21.6%,解得:n=4,且A中只有一个甲基,所以该一元醇是1-丁醇,在铜作催化剂、加热条件下,A被氧气氧化生成B丁醛,丁醛和氢氧化钠的水溶液发生反应生成 C,结合题给信息知,C的结构简式为:CH3CH2CH2CH=C(CH2CH3)CHO,C反应生成D,D的相对分子质量是130,则C和氢气发生加成反应生成D,则D的结构简式为:CH3CH2CH2CH2CH(CH2OH)CH2CH3,D和邻羟基苯甲酸发生酯化反应生成E,E的结构简式为: ,
,
(1)通过以上分析知,A的分子式为:C4H10O,结构分析显示A只有一个甲基,A的名称为1-丁醇,
故答案为:C4H10O;1-丁醇(或正丁醇);
(2)加热条件下,丁醛和新制氢氧化铜反应生成丁酸钠、氧化亚铜和水,反应方程式为:CH3CH2CH2CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O,
故答案为:CH3CH2CH2CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O;
(3)C的结构简式为: ,C中含有醛基和碳碳双键,都能和溴水反应,要检验两种官能团,则应先用银氨溶液检验醛基,然后再用溴水检验碳碳双键,检验方法为:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键,
,C中含有醛基和碳碳双键,都能和溴水反应,要检验两种官能团,则应先用银氨溶液检验醛基,然后再用溴水检验碳碳双键,检验方法为:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键,
故答案为: ;用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键;
;用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键;
(4)a.分子中有6个碳原子在一条直线上,则该分子中含有两个碳碳三键;b.分子中含有一个羟基和一个羧基,所以与水杨酸互为同分异构体的结构简式为:HOCH2C≡C-C≡CCH2COOH、 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、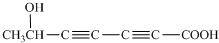 ,
,
故答案为:HOCH2C≡C-C≡CCH2COOH、 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、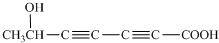 ;
;
(5)第④步的反应是酯化反应,根据乙酸乙酯的反应条件知,该反应条件是浓硫酸作催化剂、加热,通过以上分析知,E的结构简式为: ,
,
故答案为:浓H2SO4、加热; .
.
点评 本题考查有机物的推断,题目难度中等,正确推断出A物质是解本题关键,结合题给信息进行分析解答,溴水能氧化醛基,为易错点,注意掌握常见有机物结构与性质.


科目:高中化学 来源: 题型:选择题
| A. | 16O与18O为同种核素 | |
| B. | 16O═C═18O与16O═C═16O互为同位素 | |
| C. | 16O═C═18O与16O═C═16O的化学性质几乎完全相同 | |
| D. | 目前提出的“低碳经济”的目标是向空气中增加CO2,促进碳的平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 深入农村和社区宣传环保知识 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
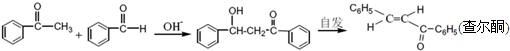
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键角是确定多原子分子立体结构(分子形状)的重要参数 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 共价键的键长越长,键能则越小,共价化合物也就越稳定 | |
| D. | 同种原子间形成的共价键键长:叁键<双键<单键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Z单质的化学活泼性一定比Y单质的强 | |
| B. | W的原子序数可能是Y的原子序数的2倍 | |
| C. | W的气态氢化物的稳定性一定比Y的强 | |
| D. | X和W两元素不可能形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+ )>c(H+)>c(OH-) | B. | c(B+ )+c(H+ )=c(A-)+c(OH-) | ||
| C. | c(B+ )>c(A-)>c(H+ )=c(OH-) | D. | c(BOH)+c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
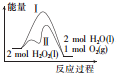
| A. | 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 | |
| B. | 2 molH2O2(l)的能量高于2 molH2O(l)的能量 | |
| C. | 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ | |
| D. | 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com