
| A. | Na+、OH-、Cl-、HCO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | Cl-、NH4+、Ag+、NO3- |
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 蛋白质在一定条件下发生水解反应生成葡萄糖 | |
| C. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程 | |
| D. | 合成材料的大量使用给人类带来了严重污染,所以要禁止生产和使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极反应为:VO2++2H++e-=VO2++H2O | |
| B. | 放电时每转移2mol电子时,消耗1mol氧化剂 | |
| C. | 充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极 | |
| D. | 放电过程中,H+由正极移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米材料是指一种称为“纳米”的新物质制成的材料 | |
| B. | 复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单一材料 | |
| C. | 淀粉和纤维素通式都是(C6H10O5)n,都是天然高分子化合物 | |
| D. | 合成纤维的主要原料是石油、天然气、煤等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol NaNO3需消耗0.4 mol KMnO4 | |
| B. | 反应过程中溶液的酸性增强 | |
| C. | 该反应中NO2-被还原 | |
| D. | H+可以是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 50mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
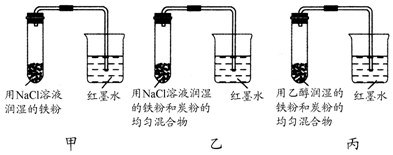
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com