
| A. | 0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
分析 A.苯不是单双键交替的结构;
B.根据氯原子的守恒来分析;
C.SO2与足量氧气反应生成SO3的反应为可逆反应,不能进行彻底;
D.电解精炼铜过程中,阳极粗铜中含有杂质铁、锌等,所以阳极质量减少6.4g时,转移的电子的物质的量不一定是0.2mol.
解答 解:A.苯不是单双键交替的结构,其分子中不含碳碳双键,故A错误;
B.1mol氯气中共含2mol氯原子,而氯气与水的反应为可逆反应,不能进行彻底,故溶液中有HClO分子、ClO-、Cl-、Cl2分子,根据氯原子的守恒可有:2NA=N(HClO)+N(Cl-)+N(ClO-)+2N(Cl2),即N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)],故B正确;
C.SO2与足量氧气反应生成SO3的反应为可逆反应,不能进行彻底,故转移电子数小于0.2NA,故C错误;
D.粗铜中含有杂质铁、锌等,所以阳极减少6.4g时,电路中转移的电子的物质的量不一定为0.2mol,转移的电子数不一定为0.2NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算与判断,题目难度中等,熟练掌握公式的使用和物质的结构是解题关键,试题培养了学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
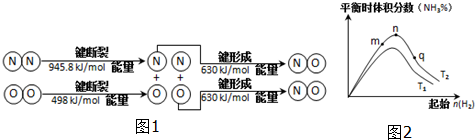
| 编 号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L(标准状况下) | 2.24L | 4.48L | 6.72L | V |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2. ,E属于元素周期表中ds区
,E属于元素周期表中ds区查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.01mol•L-1NaOH溶液与等体积pH=2的醋酸溶液混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解 | |
| B. | 反应后,溶液中NH4+,Fe2+,SO42-的物质的量减少,而Al3+、Cl-的物质的量不变 | |
| C. | Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化 | |
| D. | 该实验中共有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com