
| A. | 难溶电解质沉淀的速率和溶解的速率相等 | |
| B. | 溶液中各离子的浓度不再改变 | |
| C. | 难溶电解质在水中形成饱和溶液 | |
| D. | 加水可使难溶电解质的KSP增大 |
科目:高中化学 来源: 题型:解答题

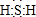 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2×10-10 mol/L | B. | 2.2×10-12 mol/L | C. | 2.2×10-14 mol/L | D. | 1.1×10-21 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 | |
| B. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的 Ca2+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | B. | Mg2+ N${H}_{4}^{+}$ S${O}_{4}^{2-}$ Cl- | ||
| C. | Na+ K+ S${O}_{4}^{2-}$ N${O}_{3}^{-}$ | D. | Ba2+ Na+ Mn${O}_{4}^{-}$ S${O}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示.X位于元素周期表中第四周期ⅠB族.
A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示.X位于元素周期表中第四周期ⅠB族. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的催化裂化是为了提高汽油等轻质油的产量和质量 | |
| B. | 石油裂解可得到汽油 | |
| C. | 煤的气化和液化均为物理变化 | |
| D. | 石油在分馏过程中最先得到的馏分是柴油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com