
| A. | 分子晶体中一定存在范德华力和共价键两种作用力,可能存在氢键 | |
| B. | 某晶体熔融态能导电,则一定是离子晶体 | |
| C. | 分子晶体、原子晶体、离子晶体、金属晶体都可以采用紧密堆积方式 | |
| D. | 金属元素形成的化合物可能是分子晶体 |
分析 A、有些分子为单原子分子,不存在共价键;
B、含有自由离子或电子的物质能导电,熔融状态下能导电的晶体不一定是离子晶体;
C、原子晶体是原子以具有方向性和饱和性的共价键结合形成的,不能紧密堆积,不遵循“紧密堆积”原理;
D、氯化铝形成分子晶体.
解答 解:A、稀有气体为单原子分子,不存在化学键,故A错误;
B、熔融状态下能导电的晶体可能是金属晶体或离子晶体,故B错误;
C、原子晶体是原子以具有方向性和饱和性的共价键结合形成的,不能紧密堆积,不遵循“紧密堆积”原理,故C错误;
D、氯化铝形成分子晶体,故D正确;
故选D.
点评 本题考查较综合,涉及导电性、化合物和化学键的关系、晶体的类型与成键元素性质之间的关系等知识点,这些知识点都是考试热点,难度不大.


科目:高中化学 来源: 题型:解答题
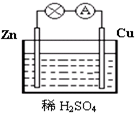 图为原电池的示意图.请回答:
图为原电池的示意图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ⑤⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于7的雨水即为酸雨 | |
| B. | 用食醋可除去水壶内壁上的水垢 | |
| C. | 为了除去MgCl2酸性溶液的Fe3+,可在加热搅拌的条件下加入氨水 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com