
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() +CO2
+CO2![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.上述反应属于加成反应
B.碳酸亚乙酯的所有二氯代物中均存在手性碳原子
C.碳酸亚乙酯中的所有氧原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
科目:高中化学 来源: 题型:
【题目】三位分别来自法国、美国、荷兰的科学家因研究“分子机器的设计与合成”而获得2016年诺贝尔化学奖。纳米分子机器日益受到关注,机器的“车轮”常用组件如图。下列说法不正确的是( )
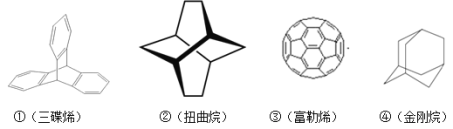
A.①③均能发生加成反应
B.②④互为同分异构体
C.①②③④均属于烃
D.①②④的一氯代物分别为3种、3种、2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A.该混合溶液中c(HA)+c(A-)=c(Na+)
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.HA是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr3+基态核外电子排布式为__________。
(2)AlCl3可做反应 的催化剂。
的催化剂。
①乙酸酐分子中发生sp3杂化的原子有_____个。
②1mol对甲基苯乙酮分子中含有σ键的数目为______mol。
③CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为________。
④单个AlCl3气态分子的空间构型为_____,AlCl3可与Cl-形成AlCl4-,与AlCl4-互为等电子体的分子为_______。
(3)某遮光剂的晶胞如图所示,由晶胞可知。n=_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应![]() 设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )
设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是( )

A.![]() 盐桥中的
盐桥中的![]() 移向
移向![]() 溶液
溶液
B.![]() 作负极,发生还原反应
作负极,发生还原反应
C.若将盐桥换成银丝,工作一段时间后,![]() 溶液中
溶液中![]() 减小
减小
D.若将盐桥换成银丝,当锌电极质量减少![]() ,银电极质量增加
,银电极质量增加![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)![]() 溶液显酸性,试用离子方程式解释其原因________。
溶液显酸性,试用离子方程式解释其原因________。
(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C时,氯化银的![]() ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①![]() 氯化镁溶液中,②
氯化镁溶液中,②![]() 硝酸银溶液中,③
硝酸银溶液中,③![]() 氯化铝溶液中,④
氯化铝溶液中,④![]() 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
弱酸 | 电离常数 | 弱酸 | 电离常数 |
|
|
|
|
|
|
|
|
①相同物质的量浓度的![]() 和
和![]() 的混合溶液中离子浓度由大到小的顺序为_________。
的混合溶液中离子浓度由大到小的顺序为_________。
②请判断![]() 溶液显_________性(填“酸”、“碱”或“中”)。
溶液显_________性(填“酸”、“碱”或“中”)。
③下列离子方程式书写正确的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是
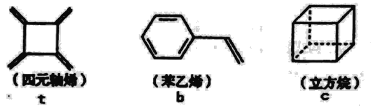
A.b的同分异构体只有t和c两种B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三种D.b中所有原子-定不在同-个平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学为测定该盐酸的浓度,在实验室中进行了如下实验。
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→冷却→转移→洗涤(并将洗涤液移入容量瓶)→振荡→_________→__________→装瓶→贴标签。
②称量________g氢氧化钠固体粉末,所需仪器有:托盘天平(带砝码和镊子)、___________、小烧瓶。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) | |
1 | 0.10 | 29.80 | 20.00 | |
2 | 0.10 | 30.00 | 20.00 | |
3 | 0.10 | 30.20 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的____________(选择甲、乙、丙填空),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
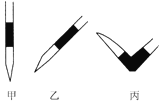
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molX和0.8molY置于体积为2L的恒容密闭容器中,发生反应:2X(g)+Y(s)![]() M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
M(g)+N(g) △H。反应过程中测得N的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
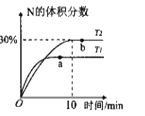
A.无论温度为T1还是T2,当容器中气体密度不变或压强不变时,反应达平衡状态
B.温度为T2时,X的平衡转化率为60%,平衡常数K=5.625
C.T1、T2的平衡常数分别为K1、K2,则K1<K2
D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com