
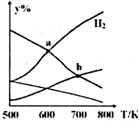
 以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )
以CO2和H2为原料制取乙醇的反应为:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g)△H<0.某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下,达到平衡后平衡体系中各物质的物质的量分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | B. | b点:v正(CO2)=v逆(H2O) | ||
| C. | a点:n(H2)=n(H2O) | D. | 温度不变,充入更多H2,D(CO2)不变 |
分析 A、平衡常数仅与温度有关;
B、b点时反应物仍然减小,生成物仍然增大,说明平衡向正反应方向进行;
C、根据图象分析,a点为H2和H2O物质的量的交点;
D、其他条件恒定,充入更多H2,增大反应物的浓度则正反应速率增大,所以v(CO2)也增大.
解答 解:A、因为平衡常数仅与温度有关,该反应为放热反应,升高温度平衡向逆反应移动,所以温度越低,K越大,所以Ka>Kb,故A错误;
B、b点时反应物仍然减小,生成物仍然增大,说明平衡向正反应方向进行,所以v正(CO2)≠v逆(H2O),故B错误;
C、根据图象分析,a点为H2和H2O物质的量的交点,所以相等,故C正确;
D、其他条件恒定,充入更多H2,增大反应物的浓度则正反应速率增大,所以v(CO2)也增大,故D错误;
故选:C.
点评 本题考查平衡移动原理、平衡常数的判断等,难度中等,注意判断曲线表示哪一物质的体积分数是关键,侧重考查学生对图象的分析与平衡移动的理解,难度较大.


科目:高中化学 来源: 题型:解答题
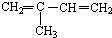 与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br.
与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,OPA分子中最多有16个原子共平面.
,OPA分子中最多有16个原子共平面.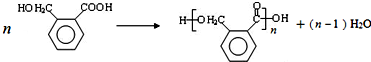 (不必注明反应条件),该反应的类型为缩聚反应.
(不必注明反应条件),该反应的类型为缩聚反应.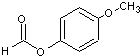 (写出其结构简式).
(写出其结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 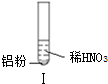 | 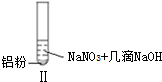 | 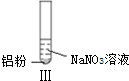 |
| 现象 | 溶液无色,试管上方 呈红棕色 | 产生大量气泡,能使湿润红 色石蕊试纸变蓝 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
| A. | 实验Ⅰ试管上方呈现红棕色的原因是:2NO+O2=2NO2 | |
| B. | 根据实验Ⅱ、Ⅲ的气体检验结果,说明都有NH3产生 | |
| C. | 实验Ⅰ溶液中发生的反应是:Al+6H++3NO3-=Al3++3NO2↑+3H2O | |
| D. | 在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
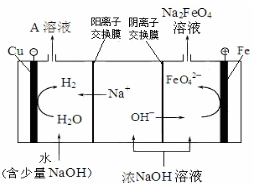
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
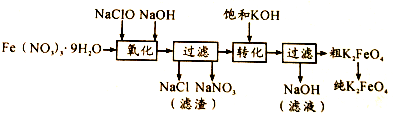
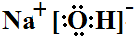 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
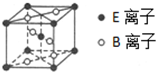 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com