
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有水解 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.应利用最高价氧化物水化物的酸性比较非金属性比较;
B.在加入硝酸银溶液之前必须先加入稀硝酸,否则不出现淡黄色沉淀;
C.溶度积表达式相同的物质,溶度积常数小的先产生沉淀;
D.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答 解:A.测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,Na2CO3的水解程度大,前者的pH比后者的大,不能比较非金属性,应利用最高价氧化物水化物的酸性比较非金属性比较,故A错误;
B.在加入硝酸银溶液之前必须先加稀硝酸中和未反应的NaOH,防止硝酸银和NaOH反应而干扰溴离子的检验,故B错误;
C.溶度积表达式相同的物质,溶度积常数小的先产生沉淀,先产生黄色沉淀说明Ksp(AgCl)>Ksp(AgI),故C错误;
D.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,该实验中下层液体显紫红色,说明有碘生成,该反应中铁离子是氧化剂、碘是氧化产物,所以氧化性:Fe3+>I2,故D正确;
故选D.
点评 本题考查化学实验评价,为高频考点,涉及溶度积大小比较、氧化性强弱比较、卤代烃中卤元素检验、非金属性强弱比较等知识点,把握实验原理及物质性质是解本题关键,注意实验评价性分析和判断,易错选项是B,题目难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③ | C. | ②③⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向NaAlO2溶液中通入过量CO2 制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- | |
| D. | 用氨水吸收足量的SO2气体:2OH-+SO2=SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ④③②① | C. | ①④②③ | D. | ②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
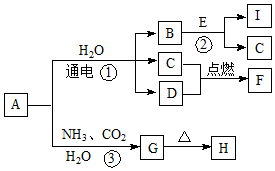
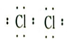 .
. 
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
①将1mol氯气通入足量水中发生反应转移电子数为NA
②12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
③在标准状况下,22.4L HF中的氟原子数为NA
④17g羟基中含有的电子数为10NA
⑤1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
⑥200mL1mol/LFe2 (SO4) 3溶液中,Fe3+和SO42-离子数的总和小于NA
A.①②⑤ B.①④⑥ C.②③⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:实验题
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
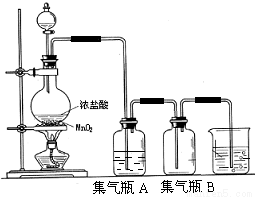
试回答下列问题:
(1)请指出 是氧化剂, _是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水 中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com