
 ���ܼ����ǵ��»����������ص㣮
���ܼ����ǵ��»����������ص㣮| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| ������� | c��CO��/mol•L-1 | c��02��/mol•L-1 | c��C02��/mol•L-1 | V��������v���棩�Ƚ� |
| �� | 2.0��10-4 | 4.0��10-4 | 4.0��10-2 | V������=v���� |
| �� | 3.0��10-4 | 4.0��10-4 | 5.0��10-2 | V�������� v���� |
���� ��1���ٽ�ϻ�ѧƽ������ʽ��ʽ���㣬������һ����̼���ʵ���Ϊx
CO ��g��+H2O��g��?CO2��g��+H2��g��
��ʼ����mol�� 0.2 0.2 0 0
�仯����mol�� x x x x
ƽ������mol��0.2-x 0.2-x x x
800�棬��2L�����ܱ������дﵽƽ��״̬��K=l��
ƽ�ⳣ��K=$\frac{{x}^{2}}{��0.2-x��^{2}}$=1
x=0.1
��Ӧ����v=$\frac{��c}{��t}$��ת����=$\frac{������}{��ʼ��}$��100%����õ���
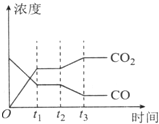
����ͼ��֪��t2ʱ�̺������̼Ũ������һ����̼Ũ�ȼ�С���ı�������ƽ��������Ӧ�����ƶ������ƽ���ƶ�ԭ���뷴Ӧ�ص�������
��2����I������������ȣ�����ƽ��״̬������I�����ݼ�����¶���ƽ�ⳣ�����ټ������Ũ���̣���ƽ�ⳣ���Ƚ��жϷ�Ӧ�������������ȷ�������淴Ӧ���ʹ�ϵ��
����ƽ��ʱCO��Ũ�ȱ仯��Ϊxmol/L����������ʽ��ʾƽ��ʱ����ֵ�Ũ�ȣ�������ƽ�ⳣ���з��̼��㣻
��3���������Ϻ���Һ��̼�����Ũ��Ϊ1��l0-4mol/L�������ܶȻ�������Ҫ������Ũ�ȣ��ٸ���ϡ�Ͷ��ɼ�������CaCl2��Һ����СŨ�ȣ�
��� �⣺��1����������һ����̼���ʵ���Ϊx��
CO ��g��+H2O��g��?CO2��g��+H2��g��
��ʼ����mol�� 0.2 0.2 0 0
�仯����mol�� x x x x
ƽ������mol��0.2-x 0.2-x x x
800�棬��2L�����ܱ������дﵽƽ��״̬��K=l��
ƽ�ⳣ��K=$\frac{{x}^{2}}{��0.2-x��^{2}}$=1�����x=0.1��
������CO2��ʾ�÷�Ӧ�ķ�Ӧ����v��CO2��=$\frac{��c}{��t}$=$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/��L•min����
ƽ��ʱ��������CO��ת����=$\frac{������}{��ʼ��}$��100%=$\frac{0.1mol}{0.2mol}$��100%=50%��
�ʴ�Ϊ��0.01mol/��L•min����50%��
����ͼ��֪��t2ʱ�̺������̼Ũ������һ����̼Ũ�ȼ�С���ı�������ƽ��������Ӧ�����ƶ�����Ӧ�Ƿ��ȷ�Ӧ���ɼ����¶�ʹƽ��������У���������Ũ�Ȼ�����ˮ������Ũ�ȣ�ʹƽ��������Ӧ�����ƶ���
�ʴ�Ϊ�������¶Ȼ�H2Ũ�Ȼ�����H2O��g��Ũ�ȣ�
��2����I������������ȣ�����ƽ��״̬�����¶���ƽ�ⳣ��K=$\frac{4��{0}^{-2}}{2.0��1{0}^{-4}����4��1{0}^{-4}��^{\frac{1}{2}}}$=104������Ũ����Qc=$\frac{5��1{0}^{-2}}{3��1{0}^{-4}����4��1{0}^{-4}��^{\frac{1}{2}}}$=8.3��103��104���ʷ�Ӧ������Ӧ���У���v��������v���棩��
�ʴ�Ϊ������
����CO��Ũ�ȱ仯��Ϊxmol/L����
CO��g��+$\frac{1}{2}$O2��g��?CO2��g��
��ʼ��mol/L����1.0��10-5 1.0��10-4
�仯��mol/L����x x
ƽ�⣨mol/L����1.0��10-5 -x 1.0��10-4 1.0��10-4+x
��$\frac{��1��1{0}^{-4}+x��}{��1��1{0}^{-5}-x������1��1{0}^{-4}��^{\frac{1}{2}}}$=104�����x=8.91��10-6mol/L��
��ƽ��ʱCOŨ��Ϊ1.0��10-5mol-8.91��10-6mol=1.1��10-6mol/L
�ʴ�Ϊ��1.1��10-6��
��3���������Ϻ���Һ��̼�����Ũ��Ϊ2��l0-4mol/L��2=1��l0-4mol/L��Ҫ����CaCO3������Ҫ������Ũ��Ϊ$\frac{2.8��1{0}^{-9}}{1��1{0}^{-4}}$mol/L=2.8��l0-5mol/L������ҪCaCl2��Һ����СŨ��Ϊ2.8��l0-5mol/L��2=5.6��l0-5mol/L��
�ʴ�Ϊ��5.6��10-5��
���� ���⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ�����ƴ������Ŀ���漰��ѧ��Ӧ���ʼ��㡢��ѧƽ���ƶ���ƽ�ⳣ��Ӧ�á��ܶȻ����㣬�Ѷ��еȣ���3����ע��������Ϻ�̼�����Ũ�ȱ仯��������ؿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �٢� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʲ�һ���ܵ��� | |
| B�� | ������ˮ�õ��İ�ˮ�ܵ��磬����ˮ�ǵ���� | |
| C�� | �����ᱵ����ˮ�в��ܵ��磬�������ᱵ�Ƿǵ���� | |
| D�� | ��ˮ��Һ������״̬���ܵ�������ʽ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
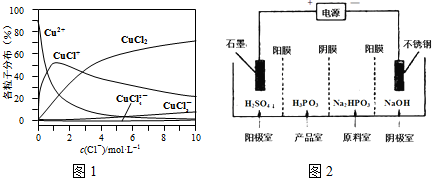
| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ����ӦΪ2Cu+H2O$\frac{\underline{\;���\;}}{\;}$Cu2O+H2���� |
| ������ | ���£�N2H4����ԭ����Cu��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ����0.02500mol/L�ı�������Һ�ζ�ijδ֪Ũ�ȵ�����������Һ���й����ݼ�¼�����
����0.02500mol/L�ı�������Һ�ζ�ijδ֪Ũ�ȵ�����������Һ���й����ݼ�¼�����| ��� | ����Һ�����ml�� | �����ı�����������ml�� | ||
| �ζ�ǰ | �ζ��� | ������� | ||
| 1 | 25.00 | 1.00 | 27.30 | 26.30 |
| 2 | 25.00 | �� | �� | �� |
| 3 | 25.00 | 1.50 | 27.84 | 26.34 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ʵ���ҳ������·�����ȡ������MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$ MnCl2+Cl2��+2H2O��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�ã����������ѧ֪ʶ�ش�
ʵ���ҳ������·�����ȡ������MnO2+4HCl��Ũ�� $\frac{\underline{\;\;��\;\;}}{\;}$ MnCl2+Cl2��+2H2O��������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ������������������Ҫ��Ӧ�ã����������ѧ֪ʶ�ش��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com