
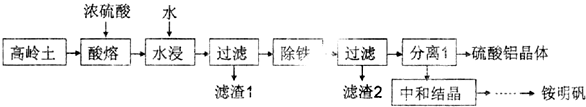
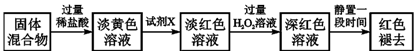
���� ��������Ũ�����ܽ⣬Al2O3��Fe2O3��Ӧ�õ�Al2��SO4��3��Fe2��SO4��3��SiO2�������ᷴӦ�����˵õ�����1ΪSiO2����Һ�к���Al2��SO4��3��Fe2��SO4��3��ʣ������ᣬ�����Ŀ�������
��1�����˲����л�ʹ�õ��IJ����������ձ�����������©����
��2���������ܺ�KSCN��Һ��Ӧ����Ѫ��ɫ��Һ��
��3���ٳ������ٵķ�Ӧ�����������ܽ�������������Һ�ķ�Ӧ��
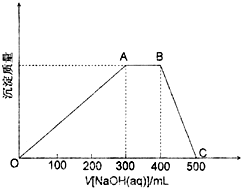
�ڸ���ͼ��B��C��֪�ܽ���������������n��Al3+����A��B��NH4++OH-��NH3��H2O��n��NH4+�������ݸ��ݵ���غ� �����n��SO42-�������������غ� �����n��H2O�����ɵ�������Ļ�ѧʽ��
��� �⣺��1�����˲����л�ʹ�õ��IJ����������ձ�����������©����
�ʴ�Ϊ��©����
��2������2����Ҫ�ɷ�ΪFe��OH��3���������ܺ�KSCN��Һ��Ӧ����Ѫ��ɫ��Һ������Ҫ������������Һ���Ƿ���Fe3+��Ӧ��ȡ��ʵ�鷽��Ϊȡ�������������Һ���Թ��У��μӼ���KSCN��Һ������Һ��ΪѪ��ɫ��Fe3+������Fe3+����
�ʴ�Ϊ��Fe��OH��3��ȡ�������������Һ���Թ��У��μӼ���KSCN��Һ������Һ��ΪѪ��ɫ��Fe3+������Fe3+��
��3���ٳ������ٹ��̣���BC�Σ��з�����Ӧ���������������ܽ�������������Һ�еķ�Ӧ����Ӧ�Ļ�ѧ����ʽΪAl��OH��3+NaOH=NaAlO2+2H2O��
�ʴ�Ϊ��Al��OH��3+NaOH=NaAlO2+2H2O��
�ڸ���ͼ��B��C��֪�ܽ���������������ȥ100mL����������Һ����Al��OH��3+NaOH=NaAlO2+2H2O �����n��Al3+��=0.2mol/L��0.1L=0.02mol��A��B���������䣬˵��NH4++OH-��NH3��H2O���ɴ� �����n��NH4+��=0.2mol/L��0.1L=0.02mol�����ݵ���غ� �����n��SO42-��=$\frac{0.02mol+0.02mol��3}{2}$=0.04mol�����������غ� �����n��H2O��=$\frac{9.06g-0.02mol��27g/mol-0.02mol��18g/mol-0.04mol��96g/mol}{18g/mol}$=0.24mol����n��NH4+����n��Al3+����n��SO42-����n��H2O��=0.02��0.02��0.04��0.24=1��1��2��12������������Ļ�ѧʽΪNH4Al��SO4��2•12H2O��
�ʴ�Ϊ��NH4Al��SO4��2•12H2O��
���� ���⿼�����ʷ�����ᴿ��Ϊ��Ƶ���㣬���ؿ���ѧ������������ʵ��������������ȣ���ȷ����ͼ�з����ķ�Ӧ�������������������������ǽⱾ��ؼ���֪������������;�������غ���м��㣬��Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
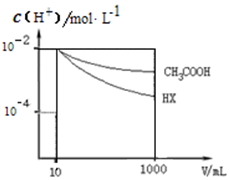 25��ʱ��������ĵ���ƽ�ⳣ�������
25��ʱ��������ĵ���ƽ�ⳣ�������| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.8��10-5 | K1 4.3��10-7 K2 5.6��10-11 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
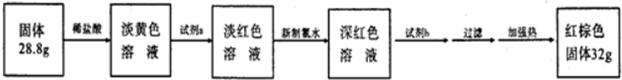
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
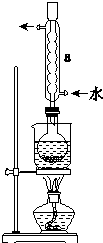 Na2S2O3����Ҫ�Ļ���ԭ�ϣ�������ˮ�������Ի���Ի������ȶ���
Na2S2O3����Ҫ�Ļ���ԭ�ϣ�������ˮ�������Ի���Ի������ȶ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ� ���� | ������Һ�������mL�� | 0.100 0mol•L-1NaOH�������mL�� | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ�����mL�� | ||
| ��һ�� | 20.00 | 0.00 | 26.11 | 26.11 |
| �ڶ��� | 20.00 | 1.56 | 30.30 | 28.74 |
| ������ | 20.00 | 0.22 | 26.31 | 26.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
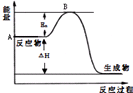 2SO2��g��+O2��g��?2SO3��g����H=a kJ•mol-1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99kJ����ش�
2SO2��g��+O2��g��?2SO3��g����H=a kJ•mol-1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99kJ����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
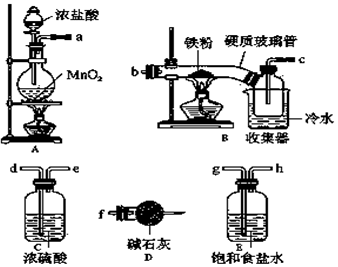
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com