
| A. | 一个甲醛分子由1个碳原子、2个氢原子、1个氧原子构成的 | |
| B. | 甲醛中碳、氢、氧三种元素的质量比为1:2:1 | |
| C. | 甲醛由碳、氢、氧三种元素组成的 | |
| D. | 甲醛中氧元素的质量分数为53.3% |
分析 A.根据标在元素符号右下角的数字表示一个分子中所含原子的个数进行解答;
B.根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
C.根据甲醛化学式(CH2O)进行分析其元素组成;
D.根据物质中某元素的质量分数=$\frac{该元素相对原子质量×原子个数}{该物质相对分子质量}$×100%,进行解答.
解答 解:A.甲醛(CH2O),标在元素符号右下角的数字表示一个分子中所含原子的个数,则一个甲醛分子由1个碳原子、2个氢原子、1个氧原子构成的;故A正确;
B.化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得甲醛中碳、氢、氧三种元素的质量比为12:2:16=6:1:8;故B错误;
C.甲醛化学式(CH2O),其由C、H、O三种元素组成,故C正确;
D.物质中某元素的质量分数=$\frac{该元素相对原子质量×原子个数}{该物质相对分子质量}$×100%,主任甲醛中氧元素的质量分数为:$\frac{16}{30}$×100%=53.3%,故D正确;
故选B.
点评 本题考查学生对物质的化学式含义的理解及物质中某元素的质量分数计算方法的掌握与应用的能力,掌握相关概念为解答关键,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
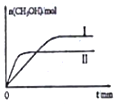 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热KJ/mol | 285.8 | 393.5 | 283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
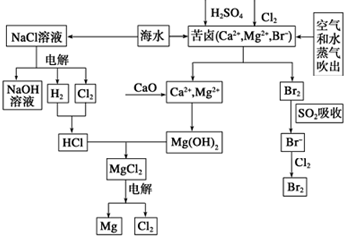 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
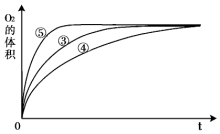 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色固体一定只含有硫酸铵 | |
| B. | 若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况) | |
| C. | 从上述数据能求算出白色固体中(NH4)2SO4、NH4HSO4的物质的量之比为1:2 | |
| D. | 将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com