
工厂的工业废水,不可直接往江河湖海中排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_______________________________。
(2)乙厂污水中含有的四种离子可能是:______________________________。
(3)对乙厂废水进行处理,方法之一,可往废水中加入一定量的________(选填
“活性碳”“硫酸亚铁”或“铁粉”),可以回收其中的金属__________(填
元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水
中的________(填离子符号)转化为沉淀,从而大大降低污染程度。过滤后所
得废水主要含________,可用于浇灌农田。
解析 (1)(2)由甲厂废水pH>7知必有OH-,则与之不能大量共存的Fe3+、
Ag+必须在乙厂废水中,由Ag+不能与Cl-、SO42-大量共存,知乙厂废水中
必有NO3-,而SO42-必在甲厂废水中,则Ba2+又必在乙厂废水中,可将8种
离子分开。
(3)乙厂废水含Fe3+、Ba2+、Ag+、NO3-,能与备选试剂反应得金属单质的只
有Fe粉,可回收Ag。
(4)对比甲厂、乙厂废水中的离子,可看出混合能生成Fe(OH)3、AgCl、BaSO4
沉淀,过滤后主要成分是KNO3,KNO3是一种化肥。
答案 (1)OH-、Cl-、SO42-、K+
(2)Fe3+、Ba2+、Ag+、NO3-
(3)铁粉 Ag
(4)OH-、Fe3+、Cl-、Ag+、SO42-、Ba2+ KNO3


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知()
A. 化学反应速率变化时,化学平衡一定发生移动
B. 化学平衡发生移动时,化学反应速率一定变化
C. 正反应进行的程度大,正反应速率一定大
D. 改变压强,化学反应速率一定改变,平衡一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
关于热化学方程式:2H2(g)+02(g)=2H20(1),△H=﹣571.6kJ•mol﹣1,下列有关叙述不正确的是()
A. 2mol H2完全燃烧生成液态水时放出571.6 kJ的热
B. 1mol H2完全燃烧生成液态水时放出285.8kJ的热
C. 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D. 上述热化学方程式可表示为H2(g)+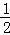 O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/molE(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+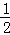 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+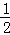 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
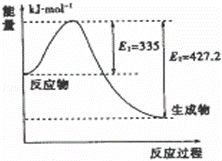
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学方程式错误的是 ( )。
A.Ca(HCO3)2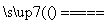 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
B.Mg(HCO3)2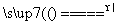 MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
C.MgCO3+H2O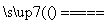 Mg(OH)2↓+CO2↑
Mg(OH)2↓+CO2↑
D.CaCO3+H2O===Ca(OH)2+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
非金属溴与氯气的性质很相似.在探究溴单质的性质时,其基本程序应该是()
A. 做实验并观察实验现象→分析、解释,得出结论
B. 观察溴的外观性质→做实验并观察实验现象→分析、 解释,得出结论
解释,得出结论
C. 观察溴的外观性质→预测溴的化学性质→做实验并观察实验现象→分析、解释,得出结论
D. 预测溴的性质→做实验并观察实验现象→分析、解释,得出结论 →观察溴的外观性质
→观察溴的外观性质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 要实现Fe2+→Fe3+的转化必须加入氧化剂
B. 失电子难的原子获得电子的能力一定强
C. 得到电子越多的氧化剂,其氧化性就越强
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪 器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用).请根据下列要求回答问题.
器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用).请根据下列要求回答问题.
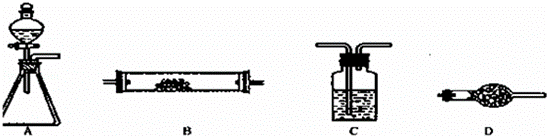
(1)若用A﹣C﹣D﹣B组合进行氢气还原氧化铜实验.分液漏斗中的试剂是盐酸,C中试剂是水,其作用是 ;A中反应开始一段时间后,再加热B.加热B之前的实验操作是 .
(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A﹣C﹣B﹣D连接成实验装置体系.A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是 (填名称);C中试剂是浓硫酸(填名称).已知高锰酸钾反应生成+2价的锰离子,写出此法制备氯气的离子方程式 .
(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是(填字母) ;装置B中发生反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com