
【题目】有一包白色粉末X,由BaCl2、K2SO4、CaCO3、NaOH、CuCl2、KCl中的一种或几种组成,为了探究其成分,进行了如下实验:

下列判断正确的是
A. 白色滤渣A可能为CaCO3、BaSO4的混合物
B. K2SO4、CuCl2一定不存在
C. KCl、K2SO4可能存在
D. CaCO3、BaCl2一定存在,NaOH可能存在
【答案】B
【解析】
由流程可知,白色固体溶于水,得到无色溶液,则一定不含CuCl2,白色滤渣A与足量稀盐酸反应生成气体D和溶液C,则滤渣A为CaCO3,不含BaSO4,生成的气体D为CO2;CO2与无色溶液B反应生成白色沉淀E和溶液F,则白色沉淀E为BaCO3,则一定含有BaCl2、NaOH,一定没有K2SO4;可能存在KCl;据此分析解答。
A.白色滤渣A只有CaCO3,不存在BaSO4,因为加入足量稀盐酸后没有沉淀剩余,故A错误;
B.结合分析可知,原混合物中一定不存在K2SO4、CuCl2,故B正确;
C.根据上述分析,可能含有KCl,一定不存在K2SO4,故C错误;
D.如果没有NaOH,BaCl2与二氧化碳不反应,无法生成碳酸钡沉淀,则一定含有NaOH,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.实验室中制备硝基苯的过程如下:
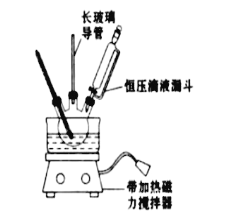
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混合酸,加入恒压滴液漏斗中.把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀.
③加热在50~60℃下发生反应,直至反说结束.
④除去混合酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后用蒸馏水洗涤得到粗产品.
⑤为了得到更纯净的硝基苯.还需先向液棒中加入试剂A,静置一段时间后弃去试剂A,然后蒸馏,最终得到17.5g硝基苯
已知:

可能用到的有关数据列表如下:

请回答下列问题:
(1)配制混酸应先在烧杯中加入_______.
(2)恒压滴液漏斗的优点是_______,实验装置中长玻璃导管可用____________代替(填仪器名称)
(3)要控制反应温度50~60℃,可用水浴加热,其优点为___________________________
(4)反应结束后产品在液体的_____层(填"上"或"下"),分离混酸和产品的操作方法为____________
(5)用10% Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?___________
(6)试剂A是________,蒸馏过程中需在蒸馏烧瓶中加入沸石,其作用为_______________若加热后,发现未加沸石,应采取的正确方法______________________________________
(7)硝基苯的产率为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取Na2CO3和高纯Si的工艺流程如图所示,下列说法错误的是
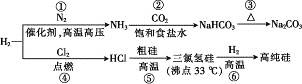
A. 反应①属于固氮反应
B. 步骤②为先向饱和食盐水中通入CO2至饱和后,再通入NH3
C. 反应⑤、⑥均为氧化还原反应
D. 用精馏的方法可提纯三氯氢硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列事实能说明醋酸是弱电解质的组合是__________(填序号)。
①醋酸与水能以任意比互溶 ②用醋酸溶液做导电实验,灯泡很暗
③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸溶液的pH为4
⑤醋酸能和碳酸钙反应放出CO2
(2)已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是____________(填序号)
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是____________(填序号)
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸 三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。(用序号表示,下同)
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
③当三者c(H+)相同且体积也相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)制取氢氧化铁胶体
①向煮沸的25mL蒸馏水中逐滴加入5~6滴_______溶液,继续煮沸至液体呈_____色,停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为_____________________.
②取少量Fe(OH)3胶体置于试管中,向试管中逐滴滴加稀盐酸,边滴边振荡.先出现红褐色沉淀,原因是胶体发生了_______,随后沉淀溶解,得到棕黄色溶液,写出该反应的化学反应方程式___________________________________________.
(2)如果FeCl3溶液中含有少量的NaCl,要除去NaCl得到纯净的FeCl3溶液,有下列方案:

试剂①是__________;试剂②是___________(均填化学式);
(3)已知:![]() 要从反应后的溶液中分离得到纯净的单质碘,需采取的操作有________、_________、_________(填操作名称)
要从反应后的溶液中分离得到纯净的单质碘,需采取的操作有________、_________、_________(填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠的原子结构示意图________。
钠与水反应的实验过程如图①、②、③所示。
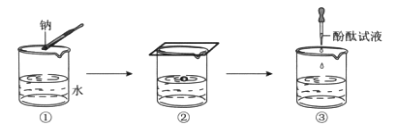
①将图②中的现象与解释用直线连接起来。_________
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈_______(填“酸”或“碱”或“中”)性。
③钠与水反应的化学方程式是_________。
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式___,与二氧化碳反应的化学方程式___。
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:
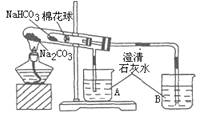
加热一段时间后,________(填“A”或“B”)中澄清石灰水变浑浊,写出澄清石灰水变浑浊的离子方程式:________。写出试管中发生反应的化学方程式________。
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。
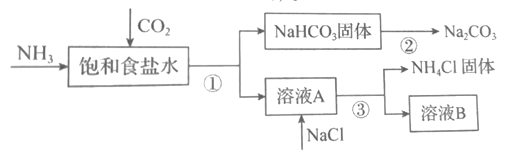
①联合制碱法所制得的“碱”是指_______(填化学式)。
②在①-③所涉及的操作方法中,包含过滤的是_______(填序号)。
③根据图,将化学方程式补充完整:NH3+CO2+___+___=NaHCO3↓+NH4Cl
④NaHCO3溶于水电离的方程式___。
⑤下列说法中,正确的是___(填字母)
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由环己烷可制得1,2—环己二醇,反应过程如下:
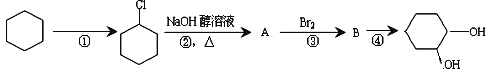
下列说法错误的是
A. ①的反应条件是光照 B. ②的反应类型是消去反应
C. ③的反应类型是取代反应 D. ④的反应条件是NaOH、H2O加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g) △H= -49.0kJ·mol-1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是

A.欲增大平衡状态时c(CH3OH)/c(CO2)的比值, 可采用 升高温度的方法
B.3min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能减小反应容器的体积
D.从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025mol·L﹣1·min﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com