
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 0.1 mol H2和0.1 mol I2在密闭容器中充分反应后,其分子总数等于0.2 NA
B. 向密闭容器中充入2 mol NO2一段时间后,容器中的分子数为2 NA
C. 1 L 0.1 mol/L H3PO4溶液中含H+数目为0.3 NA
D. 1 L 0.1 mol/L NH4Cl溶液中含有NH4+数目为0.1 NA
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 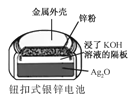 正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为_____________。
(3)苯胺![]() )的晶体类型是__________。苯胺与甲苯(
)的晶体类型是__________。苯胺与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________。
(4)NH4H2PO4中,电负性最高的元素是______;P的_______杂化轨道与O的2p轨道形成_______键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
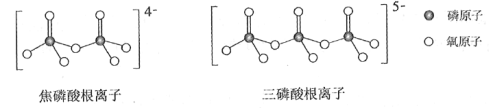
这类磷酸根离子的化学式可用通式表示为____________(用n代表P原子数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
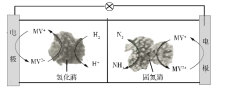
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
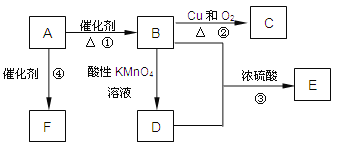
(1)F的结构简式为__________,C的名称为__________。
(2)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是_______mol;
(3)写出下列反应的化学方程式:
②__________________________________________________________;
③__________________________________________________________;
④__________________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列溶液的碱性最强的是
A. pH=11的溶液
B. 0.1 mol/L Ba(OH)2溶液
C. 1 L含有4 g NaOH的溶液
D. Kw/c(H+)=1.0×10-2的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g) ![]() B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
B(g) + D(g)在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
(1) | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
(2) | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
(3) | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
(4) | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,下列说法错误的是
A. 在(1)中,反应在10~20 min内A的平均速率为0.013 mol/(L·min)
B. 在(2)中,A的初始浓度c2<1.0 mol/L
C. 设(3)的反应速率为υ3,(1)的反应速率为υ1,则υ3 > υ1
D. 比较(1)和(4),可推测该反应的正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题小组探究乙酸乙酯(CH3COOC2H5)在不同温度、不同浓度NaOH溶液中的水解速率,取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
实验试剂 | 试管Ⅰ(55 ℃) | 试管Ⅱ(55 ℃) | 试管Ⅲ(55 ℃) | 试管Ⅳ(75 ℃) |
乙酸乙酯/mL | 1 | V1 | V2 | V3 |
1 mol/L NaOH mL | V4 | 3 | 0 | V5 |
蒸馏水/mL | 0 | V6 | 5 | 2 |
已知:①水解反应CH3COOC2H5 + H2O ![]() CH3COOH + C2H5OH;
CH3COOH + C2H5OH;
②CH3COOC2H5难溶于水,密度比水小。
(1)V4 = ____________。
(2)①下列说法正确的是____________________________;
A、加入水,平衡正向移动
B、加入稀盐酸可使平衡逆向移动
C、酯层体积不再改变时,反应停止
D、c(CH3COOH) = c(C2H5OH)时,反应达平衡状态
②用各物质的浓度表示水解平衡常数Kh,则表达式为____________。
(3)实验中常用饱和食盐水代替蒸馏水,目的是减小乙酸乙酯在水中的溶解度,会使实验结果更准确,______________填“能”或“不能”)用饱和Na2CO3溶液代替蒸馏水。
(4)实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,可能的原因有_______。(乙酸乙酯的沸点为77.1 ℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列离子方程式中,只能表示一个化学反应的是________。(填序号)
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
③Cl2+H2O=H++Cl-+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-=AgCl↓
(2)在下列反应中,HCl作还原剂的是________,HCl作氧化剂的是________。
①CaCO3+2HCl=CaCl2+CO2↑+H2O
②Fe+2HCl=FeCl2+H2↑
③PbO2+4HCl(浓) ![]() PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
④KClO3+6HCl(浓) ![]() KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
⑤CuO+2HCl=CuCl2+H2O
(3)在横线上补充所需的离子或分子,并配平方程式。
①P+FeO+CaO![]() Ca3(PO4)2+Fe ______
Ca3(PO4)2+Fe ______
②Mn2++ClO3-+H2O=MnO2↓+Cl2↑+________
(4)按要求分别用双线桥或单线桥标出下列反应中电子转移的情况。
①3NO2+H2O=2HNO3+NO(双线桥)____________
②8NH3+6NO2![]() 7N2+12H2O(单线桥)______
7N2+12H2O(单线桥)______
(5)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到________,其原因是________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会______,原因是______________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会____________,原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com