
分析 (1)氢气在氧气中燃烧放热,放热反应中反应物能量高于生成物;
(2)水分解是氢气燃烧生成水的逆反应,是吸热反应,热能转化为化学能;电解水是电能转化为化学能;
(3)①需要加热才能进行的化学反应不一定是吸热反应;
②有些放热反应需加热到一定温度引发;
③化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
④有的吸热反应在常温下也能发生;
⑤NH4Cl离子化合物,铵根离子和氯离子之间形成的是离子键,铵根离子中N原子和H原子之间形成的是极性共价键;
⑥浓硫酸溶于水是物理反应;
⑦固体氯化钠溶于水,只有离子键的断裂,但没有化学键的形成;
⑧反应物的总键能大于生成物的总键能,则该反应为吸热反应,反之为放热反应;
⑨含有离子键的化合物为离子化合物,只含有共价键的化合物为共价化合物;
⑩含有共价键的化合物可能是离子化合物;
(4)活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物属于离子化合物,只含共价键的化合物属于共价化合物,据此分析.
解答 解:(1)氢气和氧气的混合物气体遇火星即发生爆炸,可见氢气在氧气中燃烧放热,放热反应中反应物能量高于生成物,反应中化学能转化为热能,
故答案为:放热;大于;热;
(2)水在1000°C以上持续加热分解为氢气和氧气,水分解是氢气燃烧生成水的逆反应,是吸热反应,热能转化为化学能;电解水是电能转化为化学能,
故答案为:吸热;化学能;电能;化学能;
(3)①需要加热才能发生的反应不一定是吸热反应,如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点,故错误;
②铝和氧化铁发生铝热反应是典型的放热反应,但反应的条件为高温,故错误;
③放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故正确;
④有的吸热反应在常温下也能发生,如氯化铵和氢氧化钡晶体的反应,故正确;
⑤NH4Cl离子化合物,铵根离子和氯离子之间形成的是离子键,铵根离子中N原子和H原子之间形成的是极性共价键,故正确;
⑥浓硫酸溶于水是物理反应,故错误;
⑦固体氯化钠溶于水,只有离子键的断裂,没有化学键的形成,故错误;
⑧反应物的总键能大于生成物的总键能,则该反应为吸热反应,故错误;
⑨含有离子键的化合物为离子化合物,只含有共价键的化合物为共价化合物,按化学键类型可以将化合物分为离子化合物与共价化合物,故正确;
⑩含有共价键的化合物可能是离子化合物,如KOH等,故错误;
故答案为:③④⑤⑨;
(4)①Na2O2是钠离子和过氧根离子构成的离子化合物,O和O形成共价键;
②He属于单质,分子内不含有化学键;
③NaOH是钠离子和氢氧根离子构成的离子化合物,氢氧根离子内由H和O形成共价键;
④N2属于单质,分子内为N-N共价键;
⑤MgCl2是镁离子和氯离子构成的离子化合物,氯原子间没有化学键;
⑥NH3分子内为N-H共价键,为共价化合物;
⑦H2O分子内为O-H共价键,为共价化合物;
⑧Cl2属于单质,分子内为Cl-Cl共价键;
⑨NaF是钠离子和氟离子构成的离子化合物,
故答案为:⑤⑨;④⑥⑦⑧;①③⑤⑨;⑥⑦.
点评 本题综合考查化学反应与能量变化以及化学键的基础知识,注意常见吸热反应与放热反应和离子化合物以及共价化合物的判断,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 过量二氧化硫通入氢氧化钠溶液中:SO2+OH-═SO32-+H2O | |
| D. | 氯化铁溶液与铜粉反应:Cu+2Fe3+═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的球棍模型: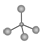 | B. | 羟基的电子式: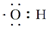 | ||
| C. | 乙醛的结构式:CH3CHO | D. | (CH3)3COH的名称:2,2二甲基乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可以与酸性高锰酸钾溶液反应,因此可以用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| B. | 溴乙烷可以通过乙烯与溴化氢加成得到,也可以通过乙烷与溴发生取代反应制备 | |
| C. | 区分甲苯和苯可以使用酸性高锰酸钾溶液,也可以用溴的四氯化碳溶液 | |
| D. | 鉴别己烯中是否混有少量甲苯,正确的实验方法是可以加足量溴的四氯化碳溶液,然后再加入酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 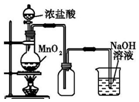 图中:如果MnO2过量,浓盐酸就可全部消耗 | |
| B. |  图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气 | |
| C. | 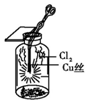 图中:生成蓝色的烟 | |
| D. | 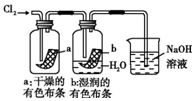 图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前O2的体积为560 mL | B. | 化合物XY3的摩尔质量为86 g/mol | ||
| C. | XY3的质量为0.99g | D. | 反应后气体总质量约为1.79 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(mim) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(ML) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com