
| A. | $\frac{1000a%}{98x}$g/ml | B. | $\frac{x}{98a%}$g/mol | C. | $\frac{98x}{a%}$g/ml | D. | $\frac{98x}{10a}$g/mol |
科目:高中化学 来源: 题型:选择题
| A. | 空气的首要污染物包括CO2、SO2、NO、NO2、O3等 | |
| B. | PM2.5指的是直径为2.5微米的可吸入颗粒物,因其直径小、比表面积大、活性强、易吸附有毒有害的物质,对人的健康和大气环境质量的影响较大 | |
| C. | 光化学烟雾的形成与氮氧化物有关 | |
| D. | SO2的治理技术和设备有:原煤脱硫技术、改进燃烧技术和烟气脱硫设备等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
| 阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外有38个电子,核内有95个质子 | B. | 核外有38个电子,核内有57个中子 | ||
| C. | 核外有57个电子,核内有57个质子 | D. | 核外有57个电子,核内有38个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
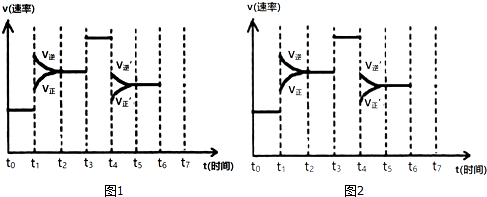
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com