
 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,分析 (1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子为Zn元素,其原子核外有30个电子,根据构造原理书写Zn的核外电子排布式;
(2)该离子价层电子对个数=2+$\frac{1}{2}×$(4+2-2×3)=2,且不含孤电子对,根据价层电子对互斥理论判断空间构型;同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素;
(3)尿素分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化类型;一个尿素分子中含有7个σ键;
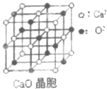
(4)该晶胞中与Ca2+等距离最近的Ca2+的个数=3×8÷2;离子晶体中晶格能越大其熔沸点越高,晶格能与离子半径成反比、与电荷成正比.
解答 解:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子为Zn元素,其原子核外有30个电子,根据构造原理书写Zn的核外电子排布式为[Ar]3d104s2,故答案为:[Ar]3d104s2;
(2)该离子价层电子对个数=2+$\frac{1}{2}×$(4+2-2×3)=2,且不含孤电子对,根据价层电子对互斥理论知空间构型为直线形;同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能Se<Sn,故答案为:直线形;Sn;
(3)尿素分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论知,N原子杂化方式为sp3;一个尿素分子中含有7个σ键,所以1mol尿素分子[CO(NH2)2]中含有的σ键的数目7NA,
故答案为:sp3;7NA;
(4)该晶胞中与Ca2+等距离最近的Ca2+的个数=3×8÷2=12;离子晶体中晶格能越大其熔沸点越高,晶格能与离子半径成反比、与电荷成正比,氧化钙中离子所带电荷大于氯化钠,所以氧化钙熔点高于氯化钠,
故答案为:12;氧化钙中离子所带电荷大于氯化钠.
点评 本题考查物质结构和性质,涉及晶胞计算、微粒空间构型判断、原子杂化方式判断、原子核外电子排布等知识点,为高频考点,利用价层电子对互斥理论、构造原理等知识点即可解答,难点是(4)题计算,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 化学平衡发生移动时,化学反应速率一定变化 | |
| C. | 正反应进行的程度越大,正反应速率一定越大 | |
| D. | 使化学反应速率发生变化,而化学平衡不移动的影响因素,一定是催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5s | B. | 1s | C. | 30s | D. | 60s |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com