
| A. | 混合气体中一定没有乙炔 | B. | 混合气体中一定有乙稀 | ||
| C. | 混合气体可能由乙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
分析 某气体由烯烃和炔烃混合而成,其密度为同条件下H2的13.5倍,相同条件下,气体的密度之比等于其摩尔质量之比,所以该混合物的相对分子质量为13.5×2=27,则该混合气体满足一种物质相对分子质量大于27、另一种物质相对分子质量小于27,据此分析解答.
解答 解:A.某气体由烯烃和炔烃混合而成,经测定其密度为同条件下H2的13.5倍,相同条件下,气体的密度之比等于其摩尔质量之比,所以该混合物的相对分子质量为13.5×2=27,乙炔的相对分子质量为26,乙烯的相对分子质量为28,所以该混合气体中一定含有乙炔,故A错误;
B.该混合气体中一定含有乙炔,乙烯的相对分子质量为28,二者1:1混合符合题意,所以可能含有乙烯,但不一定含有乙烯,故B错误;
C.该混合气体中一定含有乙炔,丙烯的相对分子质量为42>27,二者按物质的量7:1混合符合题意,所以可能含有丙烯,故C正确;
D.混合气体可能由乙烯和乙炔组成,也可能不是,故D错误,
故选:C.
点评 本题考查混合物的计算、有机物分子式的确定,难度中等,根据平均摩尔质量确定含有乙炔是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 溴水石蕊溶液 | B. | 氢氧化钠溶液和溴水 | ||
| C. | 溴水和高锰酸钾酸性溶液 | D. | 高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,脱落酸(如图)可用作植物生长抑制剂,下
,脱落酸(如图)可用作植物生长抑制剂,下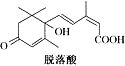 列对该物质的叙述正确的是( )
列对该物质的叙述正确的是( )| A. | 其分子式为C15H22O4 | |
| B. | 其属于芳香族化合物 | |
| C. | 能与氢氧化钠溶液反应,但不能与碳酸氢钠溶液反应 | |
| D. | 该物质在一定条件下可发生自身取代反应生成含七元环的物质. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
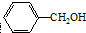 ,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )
,可用于制作香料和调味剂,还可以用作明胶、虫胶、酪蛋白及醋酸纤维等的溶剂,则苯甲醇的含苯环同分异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为$\frac{4}{15}$NA | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙烯含有的共用电子对数为2N0 | |
| B. | 常温下,含有1 mo1 NaHSO4的溶液中阳离子数为N0 | |
| C. | 通常状况下,1 mo1 NO和0.5 mo1 O2在密闭容器中混合,生成NO2分子数为N0 | |
| D. | 制取漂白粉时,标准状况下22.4 L Cl2参加反应,转移电子数为N0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com