
【题目】如图是一种染料敏化太阳能电池的示意图,电池的一个电极由有机光敏染料(R)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,下列关于该电池叙述不正确的是( )

A.染料敏化TiO2电极为电池负极,发生氧化反应
B.正极电极反应式是:I3-+2e-=3I-
C.电池总反应是:2R++3I-=I3-+2R
D.电池工作时将太阳能转化为电能
科目:高中化学 来源: 题型:
【题目】已知苯可以进行如下转化,回答下列问题:
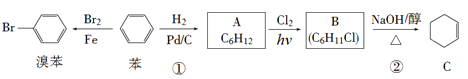
(1)反应①的反应类型为________,化合物A的化学名称为___________。
(2)化合物B的结构简式为_________,反应②的反应类型为__________。
(3)写出下列反应的化学方程式
A→B:_________________________。
B→C:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是
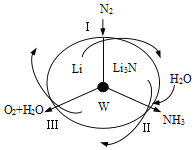
A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:
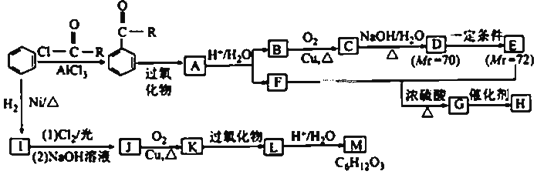
已知:①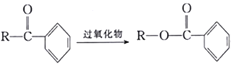 (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为___________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:________________________。
)的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol L-1NaOH溶液中,Kw=__;pH=__。
(2)氯化铁水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):__。实验室在配制氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了___(填“促进”、“抑制”)氯化铁水解。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__(填“酸性”,“中性”或“碱性”),溶液中c(Na+ )___c(CH3COO-)(填“>”,“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g)![]() xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡________(填写字母序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的物质的量为n(B)=________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.100molL-1的氨水和醋酸铵溶液中分别滴加0.100molL-1的盐酸溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法不正确的是( )
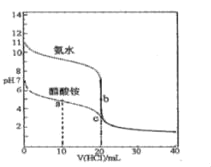
A.25℃时,Kb(NH3H2O)=Ka(CH3COOH)≈10-5
B.b点溶液中水的电离程度比c点溶液中的大
C.在c点的溶液中:c(Cl﹣)>c(CH3COOH)>c(NH4+)>c(OH﹣)
D.在a点的溶液中:c(NH4+)+2c(H+)═2c(CH3COO-)+c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中,正确的是
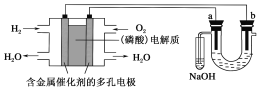
A.电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B.电解时,a电极周围首先放电的是Cl-,而不是Br-
C.电解时,电子流动路径是:负极―→外电路―→阴极―→溶液―→阳极―→正极
D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.02 g H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com