
分析 ①碳酸比硝酸弱,与硝酸钡不反应;
②酸性氧化物能与碱反应,过量的CO2与Ca(OH)2 反应:Ca(OH)2+2CO2═Ca(HCO3)2;
③碳酸酸性强于次氯酸,二氧化碳能与次氯酸钙反应,但通入过量CO2后无沉淀;
④碳酸比盐酸弱,CO2与CaCl2溶液不会反应;
⑤过量的CO2通入饱和Na2CO3溶液中发生反应生成碳酸氢钠;
⑥NaAlO2溶液通入过量的二氧化碳,可生成氢氧化铝沉淀;
⑦可生成碳酸氢钠和氯化铵,为侯氏制碱法原理;
⑧碳酸比硅酸强,过量的CO2与Na2SiO3溶液反应生成硅酸沉淀.
解答 解:①碳酸比硝酸弱,二氧化碳与Ba(NO3)2溶液不反应,没有沉淀生成,故①错误;
②酸性氧化物能与碱反应,过量的CO2与Ca(OH)2 反应:Ca(OH)2+2CO2═Ca(HCO3)2,无沉淀生成,故②错误;
③次氯酸是比碳酸还弱的酸,所以二氧化碳、水和次氯酸钙反应生成碳酸钙沉淀,但二氧化碳是过量的,过量的二氧化碳和碳酸钙能继续反应生成可溶性的碳酸氢钙,所以最终没有沉淀析出,故③错误;
④碳酸比盐酸弱,CO2与CaCl2溶液不会反应,无沉淀生成,故④错误;
⑤过量的CO2通入饱和Na2CO3溶液中发生反应:Na2CO3+H2O+CO2═2NaHCO3↓,因为碳酸氢钠溶解度比碳酸钠小,所以有NaHCO3晶体析出,故⑤正确;
⑥NaAlO2溶液通入过量的二氧化碳,由于碳酸酸性比氢氧化铝强,所以生成氢氧化铝白色沉淀和碳酸氢钠,2H2O+NaAlO2+CO2=Al(OH)3↓+NaHCO3,故⑥正确;
⑦反应发生NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,所以有NaHCO3晶体析出,故⑦正确;
⑧碳酸比硅酸强,过量的CO2与Na2SiO3溶液反应:2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,产生硅酸沉淀,故③正确;
故答案为:⑤⑥⑦⑧.
点评 本题考查了元素及其化合物的性质,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,比较基础,注意基础知识的掌握,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 | |
| B. | 铝热反应不仅被用于焊接钢轨,而且还常被用于冶炼熔点较高的金属 | |
| C. | 电解AlCl3饱和溶液,可制得金属铝 | |
| D. | Al2O3、MgO的熔点很高,可用于制作耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
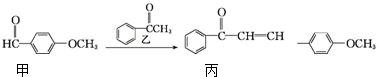
| A. | 丙的分子式为C16H14O2 | |
| B. | 丙分子中所有碳原子可能共平面 | |
| C. | 用酸性KMnO4溶液可区分甲和丙 | |
| D. | 乙在一定条件下最多与4mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 | |
| B. | 有机物一定含碳、氢元素,可能含有氧、硫等元素 | |
| C. | 在石油的分馏实验中,温度计的水银球插入石油中以测液体的温度 | |
| D. | 石油的裂化、裂解、分馏与煤的干馏均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | NaHCO3 | C. | MgSO4 | D. | Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
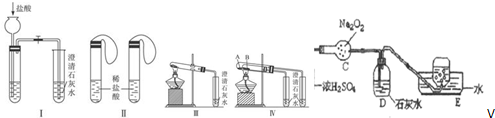
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 的结构简式可表示为 CH2CH2 | |
| B. | 6 个碳原子形成的烃分子中,最多有5个C-C单键 | |
| C. | C6H6 分子中,所有原子均可能在同一平面内 | |
| D. | C3H6 分子中一定含有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com